Взаимодействие солей с металлами – это одна из основных тем химии, которая изучает процессы, происходящие при соприкосновении этих двух классов веществ. Соли, как известно, являются ионами, то есть заряженными частицами. Металлы, в свою очередь, являются элементами, имеющими выраженные металлические свойства: проводимость тока, отличительный блеск, пластичность и другие. Их взаимодействие в многих случаях приводит к различным химическим реакциям, которые в дальнейшем могут применяться в различных областях промышленности и науки.
Существуют различные механизмы взаимодействия солей с металлами, которые зависят от конкретных условий и состава веществ. Один из наиболее распространенных способов – образование комплексных соединений, когда ионы металла образуют стабильные соединения с восемью и более молекулами соли. Комплексные соединения также могут образовываться при действии органических растворителей, таких как спирты и эфиры.
Пример взаимодействия солей и металлов можно привести на примере реакции между купоросом (сульфатом меди) и алюминием. При соприкосновении этих двух веществ происходит химическая реакция, в результате которой образуется сульфат алюминия и медный осадок. Эта реакция наблюдается при смешивании порошковых форм солей в условиях без доступа воздуха. Применение подобных реакций позволяет получать медь и алюминий в чистом виде, обладающие определенными свойствами, которые важны для их применения в различных отраслях промышленности и техники.
Взаимодействие солей со всеми металлами

Взаимодействие солей со всеми металлами является важным аспектом в химии. Соли представляют собой химические соединения, состоящие из ионов металла и кислотного радикала, и они активно взаимодействуют с металлами, образуя различные соединения.
Одной из особенностей взаимодействия солей со многими металлами является образование осадков. При смешивании раствора соли и раствора металла или при введении металлического предмета в раствор соли может образоваться осадок, который представляет собой новое вещество. Например, реакция образования осадка наблюдается при смешивании раствора соли меди (CuSO4) и раствора цинка (ZnSO4), что приводит к образованию осадка меди.
Взаимодействие солей со всеми металлами также может приводить к образованию новых соединений, которые обладают определенными свойствами. Например, образование соли железа (Fe2(SO4)3) при взаимодействии соли серной кислоты (H2SO4) с металлом железа. Это соединение имеет важное значение в промышленности и используется, например, в процессе обезжиривания и обезжелезения питьевой воды.
Взаимодействие солей со всеми металлами может также происходить в реакциях окисления-восстановления. Например, реакция образования соли меди (CuSO4) при взаимодействии с металлом цинком (Zn) является типичным примером реакции окисления-восстановления. В результате этой реакции медь окисляется, а цинк восстанавливается, образуя соединение между медью и цинком.
Таким образом, взаимодействие солей со всеми металлами является сложным и разнообразным процессом, который может приводить к образованию осадков, новых соединений и проведению реакций окисления-восстановления.
Химические реакции солей и металлов
Химические реакции солей и металлов представляют собой процессы взаимодействия между ионами солей и атомами металлов. В результате таких реакций образуются новые вещества с измененными свойствами.
Взаимодействие солей и металлов происходит на основе электронного обмена между ионами солей и атомами металлов. В результате этого обмена металл отдает или получает электроны, что приводит к образованию и новым ионам или соединениям.
Например, когда медь вступает в реакцию с солью серебра, происходит окислительно-восстановительная реакция. Атомы меди отдают электроны атомам серебра, что приводит к образованию ионов меди и ионов серебра. При этом происходит изменение окраски раствора и образование осадка из серебра.
Взаимодействие солей и металлов может иметь различные характеристики, в зависимости от специфики металла и соли. Некоторые металлы проявляют большую активность в химических реакциях с солями, такие как натрий, калий, магний. Другие металлы, например, серебро или золото, менее активны и обладают большей стабильностью.
Химические реакции солей и металлов имеют широкое применение в различных областях, включая химическую промышленность, металлургию, а также в лабораторной практике. Изучение и понимание этих реакций позволяет углубить знания о химических процессах и их приложении в различных сферах жизни.
Влияние реакций на свойства металлов
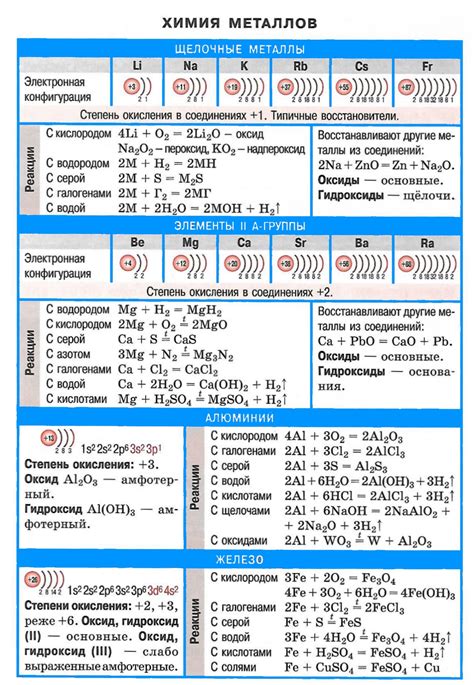
Взаимодействие солей с металлами может оказывать значительное влияние на их физические и химические свойства. В результате реакций соляных соединений с металлами происходят изменения структуры и состава поверхности металла, что может приводить к изменению его механических, электрических и других характеристик.
Например, взаимодействие солей некоторых металлов с водой может вызывать их окисление или диссоциацию. Также соли могут способствовать образованию на поверхности металла пленки оксидов, нитридов или других соединений, которые могут изменить его цвет, прочность, электропроводность и другие свойства.
Одним из примеров влияния реакций солей на свойства металлов является образование покрытий, используемых для защиты металлов от коррозии. Например, при взаимодействии железа с растворами солей цинка образуется покрытие из цинка, которое служит защитой от окисления и коррозии.
Также взаимодействие солей с металлами может приводить к образованию специфических соединений, которые найдут свое применение в различных областях. Например, реакция серебра с солями некоторых металлов позволяет получить специфические комплексные соединения, которые находят применение в катализе и других химических процессах.
Соли и их использование в промышленности
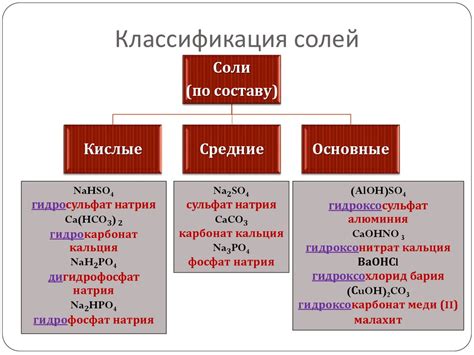
Соли, такие как хлориды, нитраты, сульфаты и фосфаты, широко применяются в различных отраслях промышленности благодаря своим уникальным свойствам и химическим реакциям.
Одним из основных способов использования солей в промышленности является производство удобрений. Фосфаты и нитраты металлов используются в качестве основных компонентов для создания минеральных удобрений, которые обогащают почву необходимыми питательными веществами для растений.
Соли также используются в производстве различных химических соединений и материалов. Например, хлориды металлов применяются в процессе получения дезинфицирующих средств, пластиков, красителей и лаков. Карбонаты металлов используются для производства стекла и щелочей. Еще одним примером является использование сульфатов для производства гипса и алюминия.
Соли находят применение в качестве электролитов в аккумуляторах. Например, свинцовые и кадмиевые соединения используются в производстве машиностроительных аккумуляторов, а литий-ионные аккумуляторы содержат литийсоли. Электролиты обеспечивают перенос ионов внутри аккумулятора, обеспечивая энергетическую эффективность и долговечность работы устройства.
Кроме того, некоторые соли применяются в качестве катализаторов в химических процессах. Например, хлориды платины и родия используются в производстве синтетических материалов, ацетона и аммиака. Соли кобальта и железа имеют каталитические свойства и широко применяются в производстве пластмасс, лакокрасочных материалов и лекарственных препаратов.
Примеры взаимодействия солей с различными металлами

Взаимодействие солей с различными металлами является одной из важных реакций в химии. Процесс включает в себя образование новых соединений и изменение свойств исходных веществ.
Например, соль серебра (AgCl) может взаимодействовать с медью (Cu) при обогревании, образуя белый осадок серебра и соли меди. Эта реакция происходит в результате отрыва йона хлора от соли серебра и образования соединения Ag + CuCl.
Другим примером является взаимодействие соли железа(II) (FeCl2) с свинцом (Pb). При взаимодействии этих веществ образуется черный осадок пломбаго, который представляет собой соединение FeS + PbCl2. Такое взаимодействие показывает, что соли могут образовывать новые соединения нбез любых ограничений.
Еще одним примером взаимодействия солей с металлами является реакция соли меди (CuSO4) и цинка (Zn). В результате происходит образование осадка меди (Cu) и соли цинка (ZnSO4). Это свидетельствует о том, что соли имеют способность образовывать новые соединения с различными металлами, что является важным аспектом химических реакций.
Особенности реакций солей с щелочными металлами

Соли – это кристаллические соединения, состоящие из ионов металла и кислотного остатка. Реакции солей с щелочными металлами обладают своими особенностями, которые важно учесть при изучении данных взаимодействий.
Первая особенность состоит в том, что щелочные металлы – это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий и цезий. Они характеризуются тем, что легко отдают свой электрон и образуют ионы положительной зарядности.
Реакция солей с щелочными металлами происходит следующим образом: ионы металла замещают ионы водорода в кислотной группе соли. Таким образом, образуется основание – гидроксид металла, и солевой остаток.
Гидроксиды щелочных металлов обладают специфическими свойствами. Они образуют сильные основания и разлагаются при нагревании, образуя оксиды металлов и воду.
Например, реакция между солью натрия и гидроксидом натрия протекает следующим образом: NaCl + NaOH → Na2O + H2O. Здесь наглядно проиллюстрировано замещение иона водорода ионом натрия, а также образование гидроксида натрия, гидроксидным остатком и итоговым продуктом реакции – оксидом натрия и водой.
Таким образом, реакции солей с щелочными металлами – это важный аспект изучения химии, который позволяет лучше понять взаимодействие различных веществ и создаёт основу для последующих исследований в этой области науки.
Взаимодействие солей с щелочноземельными металлами

Одной из особенностей взаимодействия солей с щелочноземельными металлами является их сходство в химических свойствах. Щелочноземельные металлы включают в себя бериллий, магний, кальций, стронций, барий и радий. Все они обладают высокой реакционной способностью.
Основным проявлением взаимодействия солей с щелочноземельными металлами является образование соединений, в которых металл занимает положение наибольшей электроотрицательности. Например, оксиды, гидроксиды и карбонаты щелочноземельных металлов образуются в результате реакций с кислотами, водой или углекислым газом.
Однако, взаимодействие солей с щелочноземельными металлами не всегда происходит безотказно. Некоторые соли обладают низкой растворимостью и не образуют стабильных соединений с металлами. Например, сульфаты бария и стронция являются нерастворимыми в воде и не реагируют с металлами в основных условиях.
Другим интересным аспектом взаимодействия солей с щелочноземельными металлами является их использование в различных отраслях промышленности. Например, гидроксид магния используется в производстве стекла, глинозема и других материалов. Карбонат кальция применяется в производстве строительных материалов. Таким образом, взаимодействие солей с щелочноземельными металлами имеет не только научные, но и практические применения.
Влияние реакций солей с переходными металлами на окраску

Переходные металлы обладают способностью принимать различные окраски при взаимодействии с солями. Это явление объясняется тем, что переходные металлы имеют переменное количество валентных электронов, что позволяет им образовывать соединения с разными степенями окисления.
Реакции солей с переходными металлами могут приводить к образованию окрашенных соединений. Например, взаимодействие соли меди(II) с переходными металлами, такими как железо(II) или никель, приводит к образованию окрашенных комплексных соединений. Это связано с образованием структуры комплекса, в которой переходный металл окружается солями меди и образует окрашенные ионы.
Окраска комплексных соединений, образующихся при реакциях солей с переходными металлами, зависит от типа переходного металла, его степени окисления и структуры комплекса. Например, соединения с ионами меди имеют разнообразные оттенки синего, зеленого или коричневого цвета, в зависимости от условий реакции и состава комплексного соединения.
Также, взаимодействие солей с переходными металлами может приводить к образованию окрашенных осадков. Например, при реакции солей железа(III) с солями калия образуется осадок красного или коричневого цвета, что связано с образованием гидроксидов переходного металла.
Вопрос-ответ

Что такое взаимодействие солей со всеми металлами?
Взаимодействие солей со всеми металлами - это процесс реакции солей металлов с другими металлами. В результате этой реакции могут образовываться новые соединения, а также происходить изменения физических и химических свойств металлов.
Какие особенности имеет взаимодействие солей со всеми металлами?
Одной из особенностей взаимодействия солей со всеми металлами является возможность образования осадков при смешивании растворов солей разных металлов. Кроме того, при взаимодействии солей с металлами может происходить изменение окраски растворов, образование комплексных соединений и реакции окисления-восстановления.
Можете привести примеры взаимодействия солей со всеми металлами?
Конкретные примеры взаимодействия солей со всеми металлами могут быть следующими: реакция меди(II)сульфата с цинком, при которой образуется осадок цинка(II)сульфата; реакция желез(III)хлорида с медью, при которой образуется осадок меди(II)хлорида; реакция алюминия со соляной кислотой, при которой выделяется водород.
Какое значение имеет взаимодействие солей со всеми металлами в химических процессах?
Взаимодействие солей со всеми металлами имеет большое значение в химических процессах. Это позволяет синтезировать новые соединения, проводить реакции окисления-восстановления, использовать металлы в различных областях науки и техники. Кроме того, такие реакции являются важным объектом изучения в области неорганической химии.
