Соли щелочных щелочноземельных металлов представляют собой особый класс химических соединений, получаемых при реакции щелочных и щелочноземельных металлов с кислотами. Они обладают рядом уникальных свойств, которые делают их важными и широко используемыми в различных областях науки и промышленности.
Одной из наиболее известных и широко распространенных солей щелочных щелочноземельных металлов является сода (гидрокарбонат натрия). Она используется в пищевой промышленности для регулирования кислотности и поддержания свежести продуктов. Кроме того, сода нашла применение в бытовой химии, медицине, стекольной и строительной промышленности.
Другой важной солью щелочных щелочноземельных металлов является гидроокись кальция. Она применяется в сельском хозяйстве как удобрение, способствующее увеличению плодородия почвы. Кроме того, гидроокись кальция нашла применение в строительстве и производстве бумаги.
Соли щелочных щелочноземельных металлов также широко используются в области электроудаления. Они применяются как электролиты при проведении электролиза. Благодаря своим уникальным свойствам, эти соли облегчают процесс удаления различных загрязнений и примесей.
Важно отметить, что соли щелочных щелочноземельных металлов играют важную роль не только в промышленности, но и в нашей повседневной жизни. Благодаря своим уникальным свойствам и широкому спектру применения, они стали неотъемлемой частью современной химии.
Щелочные щелочноземельные металлы: основные свойства

Щелочные щелочноземельные металлы - это группа химических элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают сходными химическими свойствами, так как имеют один электрон во внешней электронной оболочке.
Первым и наименее реактивным металлом в этой группе является литий. Он является наименьшим по размеру и наименьшей плотностью между всеми щелочными металлами. Кроме того, он имеет наименьшую температуру плавления и кипения. Литий имеет всего один изотоп, что делает его уникальным в сравнении с другими щелочными металлами.
Натрий является вторым по реактивности металлом в этой группе. Он широко используется в пищевой промышленности в качестве пищевого добавки и консерванта. Натрий также используется в производстве различных химических соединений и сплавов, а также в производстве стекла и мыла.
Калий является третьим по реактивности металлом в группе. Он широко используется в сельском хозяйстве в качестве удобрения, так как калий является основным питательным элементом для растений. Калий также используется в производстве стекла, мыла и взрывчатых веществ.
Рубидий и цезий являются самыми реактивными металлами в группе щелочных металлов. Они широко используются в научных исследованиях, включая использование в лазерной технике, атомной энергетике и в качестве радиоактивных индикаторов. Рубидий и цезий также используются для производства лекарственных препаратов и военной промышленности.
В целом, щелочные щелочноземельные металлы обладают высокой реактивностью и химической активностью. Их основные свойства являются основой для многочисленных применений в различных отраслях промышленности и научных исследованиях.
Соли: определение и свойства

Соли представляют собой химические соединения, образованные в результате реакции между кислотами и основаниями. Они представляют собой кристаллические вещества, хорошо растворимые в воде и имеющие разнообразные физические и химические свойства.
У солей есть несколько общих свойств:
- Соли обычно являются твердыми веществами при комнатной температуре, однако некоторые соли могут быть жидкими или газообразными.
- Соли обладают высокой температурой плавления и кипения.
- Соли обладают ионным строением, они состоят из положительно и отрицательно заряженных ионов.
- Соли обладают хорошими электролитическими свойствами, они легко диссоциируют в водных растворах, образуя ионы.
Соли широко применяются в различных областях, таких как пищевая промышленность, медицина, аграрная сфера, химическая промышленность и другие. Они используются в качестве пищевых добавок, лекарственных препаратов, удобрений, катализаторов и в процессах синтеза других химических соединений.
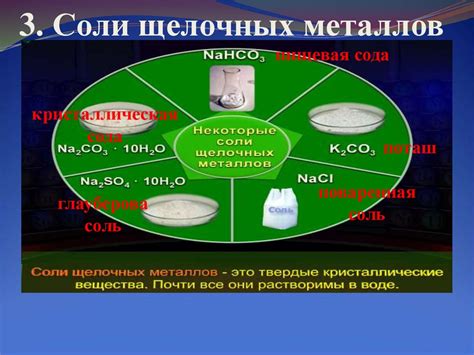
Химический состав и структура солей щелочных щелочноземельных металлов
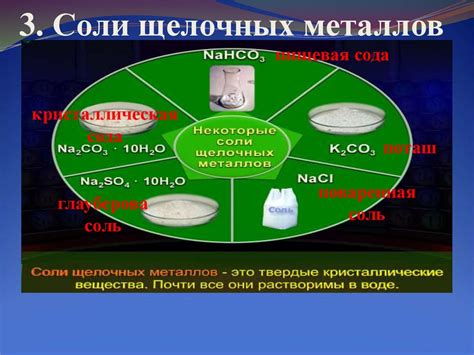
Соли щелочных щелочноземельных металлов, таких как литий, натрий, калий, магний, кальций и др., имеют свойство образовывать химически стабильные соединения с различными анинами. Химический состав этих солей определяется наличием ионов щелочной или щелочноземельной металлической основы, таких как Li+, Na+, K+, Mg2+, Ca2+ и т.д.
Структура солей щелочных щелочноземельных металлов обычно организована в виде кристаллической решетки, в которой ионы металла окружены анионами. В зависимости от размеров и заряда ионов, различные металлы и анионы могут формировать различные структуры солей. Например, хлориды щелочных металлов образуют кубическую решетку, а фосфаты щелочноземельных металлов образуют моноклинную решетку.
Эти свойства структуры солей щелочных щелочноземельных металлов важны при их применении в различных областях. Например, благодаря своей кристаллической структуре, соли щелочных металлов могут использоваться в качестве электролитов в батареях и аккумуляторах. Кроме того, структура солей может влиять на их растворимость, что имеет значение при использовании их в процессах очистки воды или при изготовлении различных химических соединений.
Физические свойства солей щелочных щелочноземельных металлов

Цвет и прозрачность: Соли щелочных щелочноземельных металлов обычно обладают яркими цветами, такими как желтый, оранжевый, красный или фиолетовый. Некоторые из них также могут быть прозрачными, непрозрачными или иметь металлический блеск.
Температура плавления и кипения: Большинство солей щелочных щелочноземельных металлов имеют высокую температуру плавления и кипения. Например, хлорид кальция имеет температуру плавления около 772 °C, а нитрат калия - около 334 °C. Это связано с силой ионных связей в структуре этих солей.
Растворимость: Многие соли щелочных щелочноземельных металлов хорошо растворяются в воде. Например, большинство хлоридов и нитратов щелочных щелочноземельных металлов образуют насыщенные растворы при комнатной температуре. Однако, некоторые соли, такие как карбонат кальция, плохо растворяются в воде.
Электропроводность: В расплавленном состоянии или в растворе соли щелочных щелочноземельных металлов обладают высокой электропроводностью. Это объясняется наличием свободно движущихся ионов в таких состояниях, которые могут передавать электрический ток.
Магнитные свойства: Некоторые соли щелочных щелочноземельных металлов могут обладать слабыми магнитными свойствами. Например, сульфаты меди(II), такие как сульфат меди(II), образуют соли ярко-синего цвета, которые могут быть магнитными при низких температурах.
Химические свойства солей щелочных щелочноземельных металлов

Соли щелочных щелочноземельных металлов обладают рядом химических свойств, которые делают их важными в различных областях применения. Во-первых, эти соли обладают высокой растворимостью в воде, что позволяет их широко использовать в различных химических реакциях и процессах.
Кроме того, соли щелочных щелочноземельных металлов обладают хорошей термической стабильностью, что делает их непригодными для использования в высокотемпературных процессах. Они также обладают высокими электропроводностями, что делает их ценными в применении в электролитах и аккумуляторах.
Однако, стоит отметить, что соли щелочных щелочноземельных металлов обладают также высокой реакционной способностью. Они могут легко вступать в химические реакции с кислотами, образуя соли, а также с другими веществами, что делает их важными компонентами в производстве различных химических продуктов.
В заключение, соли щелочных щелочноземельных металлов обладают уникальными химическими свойствами, которые делают их востребованными в различных сферах применения. Они обладают высокой растворимостью, термической стабильностью, электропроводностью и реакционной способностью, что открывает широкий спектр возможностей для их использования.
Применение солей щелочных щелочноземельных металлов в промышленности
Соли щелочных щелочноземельных металлов, таких как литий, натрий, калий, магний и кальций, широко применяются в различных отраслях промышленности.
1. Фармацевтическая промышленность: Соли щелочных щелочноземельных металлов используются в производстве многих лекарственных препаратов. Например, соль лития используется для лечения психических расстройств, а соль калия используется для борьбы со снижением содержания калия в организме.
2. Металлургическая промышленность: Соли магния и кальция используются в процессе производства стали и алюминия. Они помогают удалить нежелательные примеси и обеспечивают повышение прочности и упругости металла.
3. Химическая промышленность: Соли щелочных щелочноземельных металлов являются важными компонентами для производства различных химических веществ. Например, соль натрия используется для производства щелочи, которая широко применяется в производстве мыла, стекла и бумаги.
4. Сельское хозяйство: Соли калия и магния используются в качестве удобрений для повышения плодородия почвы. Они способствуют росту растений и улучшают качество урожая.
5. Электротехническая промышленность: Литиевые соли широко применяются в производстве аккумуляторов. Литий-ионные аккумуляторы являются эффективными и экологически чистыми источниками энергии, используемыми в ряде устройств, от мобильных телефонов до электромобилей.
Таким образом, соли щелочных щелочноземельных металлов играют важную роль в различных отраслях промышленности, обеспечивая производство разнообразных продуктов и материалов, которые необходимы для нашей повседневной жизни и развития экономики.
Применение солей щелочных щелочноземельных металлов в медицине
Соли щелочных щелочноземельных металлов, таких как калий, натрий, магний и кальций, имеют широкий спектр применений в медицине. Они высоко ценятся за свои полезные свойства и способность взаимодействовать с организмом человека.
В медицине соли щелочных щелочноземельных металлов используются для лечения различных заболеваний и состояний. Например, калий и натрий являются важными электролитами, необходимыми для поддержания нормального функционирования организма. Они играют ключевую роль в регуляции осмотического давления, pH-баланса и проводимости нервных импульсов. Калий используется в лечении сердечно-сосудистых заболеваний, а натрий помогает компенсировать потерю электролитов при диарее или рвоте.
Магний и кальций также широко применяются в медицине. Магний участвует в регуляции работы мышц и нервной системы, поддержании здоровья костей и сосудов, а также помогает в адаптации организма к стрессу. Врачи могут рекомендовать витамины с магнием для улучшения сна, снижения агрессивности и снятия симптомов пременструального синдрома.
Кальций играет ключевую роль в формировании и поддержании здоровья костей и зубов. Он также важен для свертываемости крови, функционирования мышц и нормализации кровяного давления. Кальций используется в лечении остеопороза, заболеваний зубов и для профилактики снижения костной плотности у женщин в постменопаузальном периоде.
Соли щелочных щелочноземельных металлов представляют собой ценный ресурс для медицины, обеспечивая не только лечение, но и профилактику множества заболеваний и состояний. Их использование требует отведения роль врача-специалиста и соответствующей консультации для правильного применения и дозировки этих солей в зависимости от конкретного случая и индивидуальных особенностей пациента.
Вопрос-ответ

Каково основное свойство щелочных щелочноземельных металлов?
Основное свойство щелочных щелочноземельных металлов - высокая активность. Они легко реагируют с водой, кислородом и другими веществами.
В каких отраслях применяются соли щелочных щелочноземельных металлов?
Соли щелочных щелочноземельных металлов находят применение в различных отраслях. Например, они используются в производстве стекла, мыла, моющих средств и удобрений. Также они широко применяются в медицине, фармацевтике и в производстве огнетушителей.
Какие свойства делают соли щелочных щелочноземельных металлов полезными в промышленности?
Соли щелочных щелочноземельных металлов обладают несколькими полезными свойствами. Во-первых, они обладают высокой теплопроводностью, что позволяет использовать их в производстве керамики и электроники. Во-вторых, они являются отличными катализаторами в различных химических реакциях. В-третьих, они способны образовывать стабильные соединения с другими элементами, что делает их полезными в процессе синтеза и производства различных веществ.
