Соли щелочных металлов карбоновой кислоты представляют собой химические соединения, состоящие из катиона щелочного металла и аниона карбоната. Щелочные металлы включают литий, натрий, калий, рубидий и цезий, которые являются основными элементами в данном типе солей. Карбоновая кислота, в свою очередь, является слабой двухосновной кислотой, образуя стабильные соли с щелочными металлами.
Соли щелочных металлов карбоновой кислоты обладают рядом уникальных свойств, которые определяют их широкое применение. Первое из них – хорошая растворимость в воде, благодаря чему они легко и быстро диссоциируют и образуют ионы в растворе. Это свойство обусловливает их эффективность в качестве действующих веществ в различных химических процессах и технологиях.
К примеру, соли щелочных металлов карбоновой кислоты широко используются в производстве стекла, энергетике, металлургии и фармацевтике.
Другим важным свойством солей щелочных металлов карбоновой кислоты является их щелочная природа. Они обладают высоким pH-значением, что обеспечивает щелочную реакцию со средой. Это позволяет использовать эти соли в качестве компонентов щелочных растворов или регуляторов pH в различных процессах и системах.
Также стоит отметить, что соли щелочных металлов карбоновой кислоты являются неотъемлемыми компонентами пищевых добавок и препаратов для лечения различных заболеваний. Они используются в производстве разнообразной пищевой продукции, включая напитки, кондитерские изделия, сыры, молочные продукты и другие. Благодаря своим свойствам и преимуществам, соли щелочных металлов карбоновой кислоты продолжают быть востребованными и находят широкое применение в разных отраслях промышленности.
Свойства солей щелочных металлов

Растворимость:
Соли щелочных металлов обладают высокой растворимостью в воде. Они легко диссоциируют, образуя ионы металла и карбонатную группу. Это означает, что соли щелочных металлов быстро и полностью растворяются в воде, образуя прозрачные растворы.
Щелочная реакция:
Соли щелочных металлов обладают щелочными свойствами, что означает, что они образуют щелочные растворы. Эти растворы обладают высоким pH и характеризуются щелочной реакцией. Щелочные свойства солей щелочных металлов делают их важными компонентами в производстве и использовании щелочей.
Термическая стабильность:
Соли щелочных металлов обладают высокой термической стабильностью. Это означает, что они могут выдерживать высокие температуры без разложения или изменения своих свойств. Такая стабильность делает соли щелочных металлов полезными в различных технологических процессах и при высокотемпературных условиях.
Способность к образованию комплексов:
Соли щелочных металлов обладают способностью образовывать комплексы с различными соединениями и ионами. Это свойство делает их полезными в процессах координационной химии и в качестве катализаторов во многих реакциях.
Растворимость и летучесть

Растворимость
Соли щелочных металлов карбоновой кислоты обладают высокой растворимостью в воде. Они легко диссоциируют, образуя в растворе ионы металла и карбонатные ионы. Растворы данных солей обычно имеют щелочную реакцию.
Растворимость солей щелочных металлов карбоновой кислоты также зависит от температуры. Обычно с повышением температуры растворимость увеличивается. Некоторые из этих солей нерастворимы в органических растворителях, таких как спирт или эфир.
Летучесть
Соли щелочных металлов карбоновой кислоты обладают низкой летучестью. Это означает, что при нагревании они не испаряются и не выделяются в парообразной форме. Такое свойство является важным при использовании данных солей в различных промышленных процессах, таких как производство стекла, фармацевтическая и пищевая промышленность.
Однако существуют также некоторые соли щелочных металлов карбоновой кислоты, которые могут быть летучими. Например, некоторые ацетаты щелочных металлов обладают достаточно высокой летучестью и используются в производстве аккумуляторов и других электронных устройств.
Кристаллическая структура
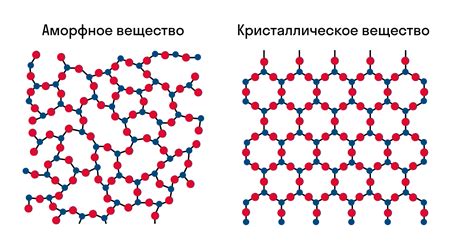
Соли щелочных металлов карбоновой кислоты обладают характерной кристаллической структурой, которая определяет их свойства и способности в различных приложениях.
Кристаллическая структура солей щелочных металлов представляет собой трехмерную решетку, состоящую из положительно заряженных ионов металла и отрицательно заряженных ионов карбонатного аниона. Эти ионы располагаются в особых позициях, формируя кристаллическую решетку, которая придает соли определенную форму.
Внутри кристаллической структуры солей щелочных металлов присутствуют различные межатомные взаимодействия, такие как ионо-иононные, ионо-дипольные и диполь-дипольные. Они обусловливают ряд характеристик солей, таких как температура плавления, растворимость и проводимость.
Соли щелочных металлов карбоновой кислоты также могут образовывать различные кристаллические модификации, которые зависят от условий образования и температурного режима. Кристаллическая структура может быть изменена путем добавления примесей или изменения условий кристаллизации, что приводит к образованию различных фаз.
Получение солей щелочных металлов

Соли щелочных металлов, таких как натрий, калий и литий, являются важными химическими соединениями, которые широко используются в различных областях промышленности и научных исследований. Получение солей щелочных металлов осуществляется различными методами, включая реакцию нейтрализации, осаждение и электролиз.
Одним из основных способов получения солей щелочных металлов является реакция нейтрализации. В этом случае, карбоновая кислота, содержащаяся в реакционной смеси, образует соль щелочного металла и воду. Например, реакция нейтрализации между уксусной кислотой и гидроксидом натрия приводит к образованию ацетата натрия и воды.
Другим методом получения солей щелочных металлов является их осаждение из растворов. В этом случае, реактив, содержащий щелочный металл, добавляется к раствору, содержащему соответствующую карбоновую кислоту. При взаимодействии этих веществ происходит осаждение соли щелочного металла в виде твердого вещества. Например, осаждение карбоната калия можно получить путем смешивания растворов хлорида калия и карбоната натрия.
Третим методом получения солей щелочных металлов является электролиз. В этом случае, раствор соли щелочного металла подвергается электрическому разложению при помощи электролизера. В результате осуществления электролиза, металлический ион соединения переходит на катод, образуя металл, а отрицательный ион переходит на анод, образуя свободный элемент или молекулярный газ. Этот метод получения солей щелочных металлов используется в производстве металлических натрия, калия и лития.
Методы получения
Соли щелочных металлов карбоновой кислоты могут быть получены различными способами. Один из наиболее распространенных методов – реакция нейтрализации металлической щелочи (например, гидроксида натрия или калия) с карбоновой кислотой. При этом происходит образование воды и соли.
Другим методом получения является реакция металла с углекислым газом. Например, металлический натрий или калий могут взаимодействовать с углекислым газом при повышенной температуре, образуя соль и выделяя газ.
Также соли щелочных металлов карбоновой кислоты можно получить из соответствующих оксидов металлов или гидроксидов путем их реакции с угольной кислотой. Результатом такой реакции будет образование соли и воды.
Для получения солей щелочных металлов карбоновой кислоты часто применяют также методы электролиза или осаждения. При электролизе в растворе карбоновой кислоты на электроды наносятся заряды, что вызывает реакцию и образование солей. При осаждении используются растворители, в которых соли недостаточно растворимы и образуют осадок.
Особенности процесса
Процесс образования солей щелочных металлов карбоновой кислоты обладает рядом особенностей, которые влияют на свойства получаемых продуктов и их применение.
Во-первых, речь идет о высокой реакционной активности щелочных металлов, таких как натрий, калий и литий. Это связано с их низкой ионизационной энергией, что позволяет им легко реагировать с карбоновыми кислотами. В результате образуется соль, которая, в отличие от щелочных металлов и карбоновой кислоты, обладает более стабильной структурой и физическими свойствами.
Во-вторых, процесс образования солей щелочных металлов карбоновой кислоты происходит с выделением воды. Данная реакция называется нейтрализацией, так как ион H+ из карбоновой кислоты и ион OH- из гидроксидов щелочных металлов образуют молекулы воды. Таким образом, водообразный продукт является неотъемлемой частью данного химического процесса.
Кроме того, соли щелочных металлов карбоновой кислоты обладают щелочными свойствами и могут применяться как основания. В реакциях с кислотами они образуют соли и воду. Благодаря этому, соли щелочных металлов карбоновой кислоты могут использоваться в различных областях, включая промышленность, медицину и пищевую промышленность.
Физические свойства солей щелочных металлов

Соли щелочных металлов, таких как литий, натрий, калий и др., обладают рядом физических свойств, которые делают их полезными в различных областях.
Во-первых, соли щелочных металлов являются кристаллическими веществами. Их кристаллическая решетка позволяет им образовывать регулярные и упорядоченные структуры. Благодаря этому, соли щелочных металлов обладают высокой устойчивостью и прочностью.
Во-вторых, соли щелочных металлов имеют высокую теплопроводность. Это означает, что они хорошо проводят тепло, что делает их полезными в промышленности, в частности, в производстве стали и алюминия.
Кроме того, соли щелочных металлов обладают высокой электропроводностью. Эта свойство делает их полезными в производстве электронных устройств, таких как транзисторы и солнечные батареи.
Одним из основных физических свойств солей щелочных металлов является их растворимость в воде. Соли щелочных металлов хорошо растворяются в воде и образуют ионные растворы. Это свойство делает их полезными в химической промышленности для различных процессов.
Наконец, соли щелочных металлов обладают высокой плотностью. Это означает, что они имеют большую массу на единицу объема. Высокая плотность делает их полезными в различных приложениях, включая производство аккумуляторов и ядерных реакторов.
Вопрос-ответ

Какие свойства обладают соли щелочных металлов карбоновой кислоты?
Соли щелочных металлов карбоновой кислоты обладают высокой растворимостью в воде, хорошей теплопроводностью и электропроводностью, а также заметным щелочным pH.
Для чего применяют соли щелочных металлов карбоновой кислоты?
Соли щелочных металлов карбоновой кислоты широко используются в различных отраслях промышленности, включая производство мыла, стекла, металлов, а также в процессах обработки текстиля и очистки воды.
Какие металлы входят в состав солей щелочных металлов карбоновой кислоты?
К солям щелочных металлов карбоновой кислоты относятся соли лития, натрия, калия, рубидия и цезия.
Какие преимущества имеют соли щелочных металлов карбоновой кислоты перед другими соединениями?
Соли щелочных металлов карбоновой кислоты обладают высокой растворимостью и устойчивостью к воздействию высоких температур и окислителей, что позволяет им широко применяться в различных процессах и производствах.
