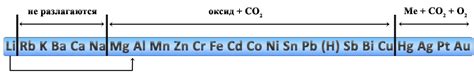
Соли активных металлов представляют собой химические соединения, содержащие ионы металла и ионы какого-либо отрицательного радикала. Эти соединения широко используются в различных отраслях промышленности и исследований. Однако, при некоторых условиях, соли активных металлов могут разлагаться до основных компонентов.
Разложение солей активных металлов происходит в результате разных процессов: термического разложения, электролиза или реакции с другими веществами. Например, при нагревании солей активных металлов до определенной температуры происходит их термическое разложение, что приводит к выделению металла в свободном состоянии.
Одной из наиболее распространенных реакций разложения солей активных металлов является электролиз. При этом процессе соли активных металлов разлагаются под действием электрического тока на ионы своих компонентов: металла и отрицательного радикала. Это позволяет получать чистые металлы и другие полезные вещества.
Разложение солей активных металлов имеет большое практическое значение в различных областях науки и техники. Например, разложение хлорида натрия при электролизе позволяет получать хлор и металлический натрий, которые широко используются в производстве различных химических соединений. Кроме того, разложение солей активных металлов является важным этапом при синтезе органических соединений и в процессе получения чистых веществ для анализа.
Соль активных металлов: разложение и состав
Соли активных металлов представляют собой соединения, состоящие из ионов металла и анионов. При определенных условиях эти соединения могут разлагаться на основные компоненты: металл и кислород.
Разложение солей активных металлов происходит при нагревании или взаимодействии с другими веществами. При нагревании соль может претерпеть термическое разложение, при котором образуются ионы металла и кислород. Также разложение солей активных металлов может происходить при контакте с кислотами или другими соединениями, способными обеспечить окислительно-восстановительные реакции.
Состав разлагающихся солей активных металлов зависит от типа металла и аниона, входящих в состав соли. Например, хлориды активных металлов (натрия, калия, магния и др.) при разложении дают ионы металла и молекулярный хлор. Сульфаты активных металлов разлагаются на ионы металла и молекулярную серу.
Разложение солей активных металлов является важной реакцией в химии, так как может быть использовано для получения металлов или других соединений. Также понимание процесса разложения солей активных металлов позволяет предсказывать и контролировать их поведение в различных условиях и реакциях.
Процесс разложения солей активных металлов
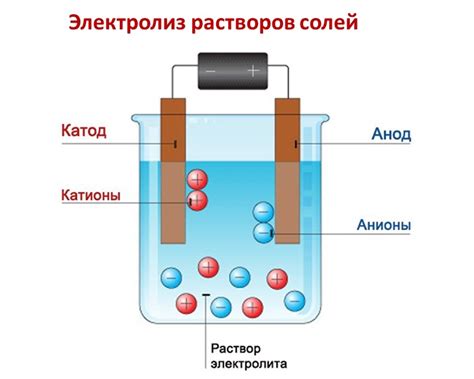
Соли активных металлов – это неорганические соединения, состоящие из ионов металла и анионов. При определенных условиях активные металлы имеют способность разлагаться до основных компонентов – металла и кислорода.
Разложение солей активных металлов является эндотермической реакцией, то есть требующей поступления тепла из внешнего источника. При нагревании соли активных металлов происходит диссоциация и образование ионов металла и кислорода.
Например, при нагревании хлорида натрия (NaCl) образуется натрий (Na) и кислород (O2). Этот процесс может быть представлен следующим уравнением реакции: 2NaCl → 2Na + O2.
Разложение солей активных металлов может быть использовано в различных процессах и технологиях. Например, в производстве металлов разложение их солей является этапом получения металлического элемента.
Также, процесс разложения солей активных металлов может применяться для получения кислорода или его соединений. Например, разложение оксида меди (II) (CuO) позволяет получить кислород: 2CuO → 2Cu + O2.
Вопрос-ответ

Почему соли активных металлов разлагаются до основных компонентов?
Соли активных металлов разлагаются до основных компонентов из-за их высокой реактивности. Активные металлы обладают большой склонностью к окислению, что приводит к их разложению в более простые соединения.
Какие основные компоненты образуются при разложении солей активных металлов?
При разложении солей активных металлов обычно образуются основные компоненты - соответствующий оксид металла и свободный элементарный металл. Например, при нагревании хлорида натрия (NaCl) находит применение метод дистилляции натрия, в ходе которого хлорид натрия разлагается на хлор водород и металлический натрий.
