Взаимодействие металлов с растворами солей является одним из основных объектов изучения в химии. Эти реакции позволяют понять, как металлы взаимодействуют с химическими соединениями и проявляют свои химические свойства.
Рассмотрим взаимодействие двух металлов - железа (Fe) и меди (Cu) с растворами их солей - сульфата железа (FeSO4) и сульфата меди (CuSO4) соответственно. Данные реакции имеют большое практическое значение и находят применение в различных областях химии, металлургии и технологии производства.
Металл железо (Fe) может взаимодействовать с раствором сульфата железа (FeSO4) по следующему уравнению реакции:
Fe + FeSO4 → Fe2(SO4)3
Уравнение реакции показывает, что металл железо окисляется и образует соединение с сульфатным ионом, при этом количество атомов железа увеличивается. Эта реакция может протекать при определенных условиях, таких как наличие кислорода или кислоты, которые могут способствовать окислительной реакции.
В свою очередь, металл медь (Cu) может вступать в реакцию с раствором сульфата меди (CuSO4) с образованием нового соединения:
2Cu + CuSO4 → Cu2SO4
Это уравнение реакции показывает, что медь окисляется, а сульфатный ион получает электроны и восстанавливается. Реакция может протекать в присутствии кислорода или других окислителей.
Взаимодействие металлов с растворами солей
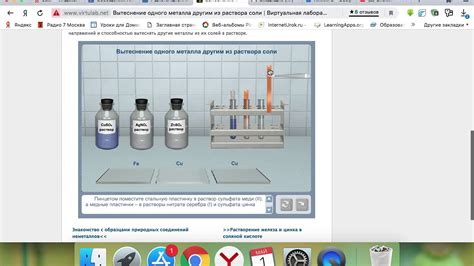
Взаимодействие металлов с растворами солей является одной из основных тем в химии. Это процесс, при котором металлы реагируют с растворами солей, образуя новые соединения и проявляя различные свойства.
Одним из примеров взаимодействия металлов с растворами солей является реакция железа (Fe) с раствором сульфата железа (FeSO4). В результате этой реакции образуется гидратированный сульфат железа (FeSO4•xH2O) и выделяется водород (H2).
Другой пример - взаимодействие меди (Cu) с раствором нитрата меди (Cu(NO3)2). При этом образуется нитрат меди (Cu(NO3)2) и выделяется оксид азота (NO).
Взаимодействие металлов с растворами солей может протекать как спонтанно, так и под воздействием внешних факторов, например, при нагревании или применении электрического тока. При этом металлы могут выделяться на поверхности других металлов в виде покрытий или осаждений.
Взаимодействие металлов с растворами солей имеет широкое применение в различных областях, включая электрохимию, металлургию, гальванику и другие. Изучение этих реакций позволяет получить новые материалы с нужными свойствами и применить их в различных технологиях и промышленных процессах.
Условия реакций FeSO4

Железосодержащие реакции. Реакция между сульфатом железа(II) (FeSO4) и другими веществами происходит при определенных условиях.
Взаимодействие FeSO4 с оксидами. При нагревании сульфата железа(II) с оксидами металлов, такими как медь(II) оксид (CuO), происходит реакция образования оксидов железа и освобождения металла. Уравнение реакции:
3FeSO4 + CuO → Fe3O4 + CuSO4
Реакция происходит при нагревании в открытой системе.
Взаимодействие FeSO4 с щелочью. При взаимодействии сульфата железа(II) с щелочными растворами, такими как гидроксид натрия (NaOH), образуется осадок гидроксида железа(II) (Fe(OH)2). Уравнение реакции:
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
Реакция происходит при комнатной температуре.
Взаимодействие FeSO4 с нитратами. При реакции между сульфатом железа(II) и нитратами других металлов, например, нитратом меди (Cu(NO3)2), образуется нитрат железа(II) (Fe(NO3)2) и освобождается металл. Уравнение реакции:
FeSO4 + Cu(NO3)2 → Fe(NO3)2 + CuSO4
Реакция происходит при комнатной температуре и дополнительном перемешивании.
Условия реакций Cu

Металл Cu, также известный как медь, является активным элементом, поэтому его взаимодействие с растворами солей происходит при определенных условиях. Важно отметить, что медь образует различные соли, такие как CuSO4 (сульфат меди), CuCl2 (хлорид меди) и другие.
Одной из главных условий, необходимых для реакции Cu, является наличие раствора соли, содержащей ион меди Cu2+. Ион меди Cu2+ играет ключевую роль в реакции, так как он способен вступать во взаимодействие с другими веществами, образуя осадок или растворяясь в реагентах.
Еще одним условием для реакции Cu является наличие редуктора или окислителя, которые обеспечивают изменение валентности иона меди. Например, медь может взаимодействовать с раствором FeSO4 в присутствии концентрированной серной кислоты (H2SO4) как редуктора. Это приводит к окислению меди из валентности +2 в +1 и одновременному образованию осадка FeSO4.
Также важно учитывать pH раствора, так как медь может образовывать осадок при определенных значениях pH. Например, соли меди могут осаждаться при щелочной или нейтральной среде. Однако при кислотной среде медь может растворяться, образуя ионы меди Cu2+.
Таким образом, для реакции Cu необходимо наличие раствора соли меди Cu2+, наличие редуктора или окислителя, pH раствора и других реагентов, которые могут взаимодействовать с ионами меди и изменять их валентность.
Вопрос-ответ

Какие условия необходимы для взаимодействия металлов с растворами солей?
Для взаимодействия металлов с растворами солей необходимо наличие электролита - раствора соли, и проводящего элемента - металла. Также важно, чтобы металл имел низкую потенциальную энергию окисления, что позволит ему вытеснить металл из соли.
Как выглядит уравнение реакции взаимодействия железа (Fe) с раствором сульфата меди (CuSO4) ?
Уравнение реакции выглядит следующим образом: Fe + CuSO4 -> FeSO4 + Cu.
Что произойдет, если смешать раствор сульфата железа (FeSO4) с раствором сульфата меди (CuSO4)?
При смешивании растворов сульфата железа и сульфата меди произойдет реакция взаимодействия металлов. Железо вытеснит медь из соли, образуя раствор сульфата железа и медный осадок. Уравнение реакции выглядит следующим образом: FeSO4 + Cu -> Fe + CuSO4.
Есть ли другие реакции, кроме взаимодействия железа (Fe) с раствором сульфата меди (CuSO4)?
Да, помимо взаимодействия железа с раствором сульфата меди, существуют и другие реакции взаимодействия металлов с растворами солей. Например, реакция взаимодействия меди с раствором сульфата цинка: CuSO4 + Zn -> ZnSO4 + Cu.
