Солеобразующие оксиды металлов и основания представляют собой особую группу химических соединений, обладающих уникальными свойствами. Эти соединения играют важную роль в химических реакциях и имеют широкое применение в различных отраслях науки и техники.
Одним из основных свойств солеобразующих оксидов металлов является их способность образовывать соли. Это происходит в результате реакции с кислотами, в результате которой образуется соль и вода. Например, оксид натрия (Na₂O) реагирует с кислотой с образованием соли натрия (NaCl) и воды (H₂O). Это свойство позволяет использовать солеобразующие оксиды металлов для получения различных солей в химической промышленности.
Основания, образуемые солеобразующими оксидами металлов, также обладают важными свойствами. Одно из них - щелочность. Основания способны принимать протоны от кислоты, образуя соль и воду. Это свойство придает им способность нейтрализовывать кислотные растворы и использоваться в качестве антацидов. Примером основания является гидроксид натрия (NaOH), который при реакции с кислым раствором образует соль натрия и воду.
Солеобразующие оксиды металлов и основания также обладают высокой реакционной активностью. Они способны быстро проводить химические реакции, что делает их применение важным в многих процессах. Например, солеобразующие оксиды металлов широко используются при получении различных соединений, таких как оксиды, гидроксиды и соли. Основания, образуемые этими оксидами, используются в производстве удобрений, стекла, мыла и других продуктов.
Солеобразующие оксиды металлов
Солеобразующие оксиды металлов представляют собой соединения, которые имеют способность образовывать соли при реакции с кислотами или кислотными оксидами. Они играют важную роль в процессе образования оснований и, следовательно, оказывают влияние на многие химические реакции и процессы.
Свойства солеобразующих оксидов металлов определяются их химическим составом и структурой. В зависимости от этих факторов, солеобразующие оксиды металлов могут иметь различные степени активности и реакционную способность. Некоторые из них образуют соли с кислотами только при повышенных температурах или под действием катализаторов, в то время как другие металлы могут образовывать соли уже при комнатной температуре.
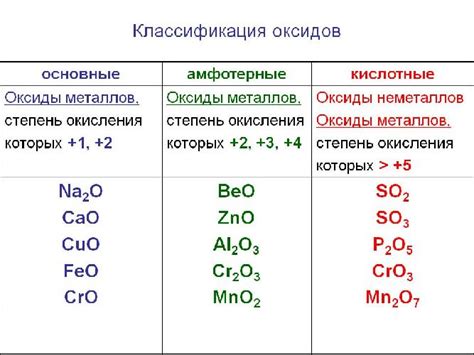
Солеобразующие оксиды металлов могут быть кислотными или основными. Кислотные оксиды образуют кислотные растворы при взаимодействии с водой и дают соли при реакции с щелочами. Основные оксиды образуют основания при взаимодействии с водой и соли при реакции с кислотами.
Примеры солеобразующих оксидов металлов включают оксиды кальция, магния, железа, алюминия и других. Многие из них широко используются в промышленности в качестве сырья для производства различных солей и оснований. Знание свойств солеобразующих оксидов металлов позволяет контролировать процессы синтеза и получения необходимых химических соединений.
Солеобразующие оксиды: определение и роль
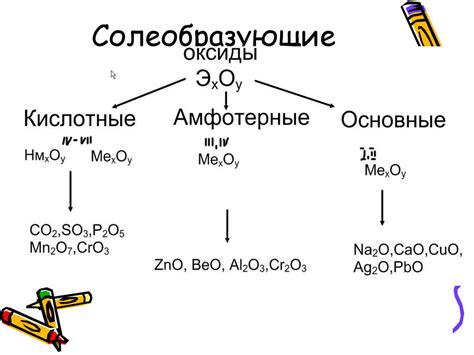
Солеобразующие оксиды - это оксиды металлов, которые способны реагировать с водой и образовывать соли или основания. Они играют важную роль в химических реакциях и имеют широкий спектр применений в промышленности и лаборатории.
Солеобразующие оксиды обладают высокой активностью и способностью к взаимодействию с водой. При контакте с водой происходит гидратация оксида, образуется гидроксид металла, а также выделяется тепло. Это позволяет использовать солеобразующие оксиды в качестве отопительных и сушильных материалов.
Реакция солеобразующего оксида с водой сопровождается образованием раствора, содержащего ионы металла и гидроксидные ионы. Таким образом, солеобразующие оксиды могут использоваться для получения различных солей, которые находят применение как пищевые добавки, лекарственные препараты, удобрения и многое другое.
Кроме того, солеобразующие оксиды выступают в роли оснований, поскольку гидроксиды металлов, образующиеся при их реакции с водой, обладают щелочными свойствами. Это означает, что они способны принимать протоны и образовывать гидроксидные ионы, которые взаимодействуют с кислотами и образуют соль и воду. Благодаря этому свойству, основания на основе солеобразующих оксидов используются в процессе нейтрализации кислот и в различных химических реакциях.
Таким образом, солеобразующие оксиды играют важную роль в химии и находят применение в различных сферах жизни. Их способность к образованию солей и оснований позволяет использовать их в промышленности, медицине, сельском хозяйстве и научных исследованиях.
Популярные примеры солеобразующих оксидов

Солеобразующие оксиды металлов играют важную роль в процессах образования оснований. Некоторые из них широко распространены и используются в различных областях промышленности и научных исследований.
Один из популярных примеров солеобразующих оксидов - оксид кальция (CaO), также известный как известь. Он является основным компонентом цемента и используется для приготовления строительных растворов. Кроме того, оксид кальция используется в производстве стекла, щелочей и многих других химических соединений.
Еще одним примером солеобразующего оксида является оксид натрия (Na2O). Этот оксид широко используется в производстве стекла, мыла, моющих средств и других химических веществ. Он также применяется в качестве основания при различных химических реакциях.
Оксид алюминия (Al2O3) - еще один известный пример солеобразующего оксида. Он используется в производстве алюминия, керамики, абразивных материалов и других товаров. Оксид алюминия также имеет высокую теплоемкость и применяется в качестве изоляционного материала.
Значительное внимание также уделяется медицинскому применению солеобразующих оксидов. Например, оксид цинка (ZnO) применяется в косметической промышленности, а также в медицинских мазях и кремах из-за своего противовоспалительного и антибактериального действия.
Одним из ключевых свойств солеобразующих оксидов металлов является их реактивность с водой. Некоторые оксиды, такие как оксид калия (K2O) или оксид натрия (Na2O), резко реагируют с водой, образуя щелочные растворы, тогда как другие оксиды, например оксид железа (Fe2O3) или оксид алюминия (Al2O3), менее реактивны и могут быть использованы в качестве кислот стабилизаторов.
Физические свойства солеобразующих оксидов
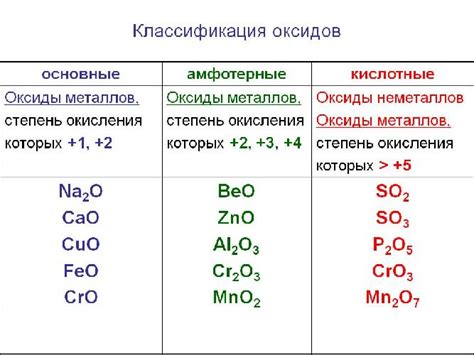
Солеобразующие оксиды металлов представляют собой соединения, которые способны образовывать соли при реакции с кислотами или основаниями. Они обладают определенными физическими свойствами, которые влияют на их химическую активность и использование в различных процессах.
Один из важных физических параметров солеобразующих оксидов - это их плотность. Плотность показывает, сколько массы оксида содержится в единице объема. Она может варьироваться в широких пределах в зависимости от состава оксида. Более плотные оксиды обычно имеют более высокую температуру плавления и кипения, что может быть связано с более сильными связями между атомами вещества.
Еще одним важным физическим свойством солеобразующих оксидов является их растворимость в воде. Некоторые оксиды металлов могут быть растворимыми, то есть способны образовывать растворы с водой, в то время как другие оксиды металлов нерастворимы и образуют осадок. Растворимость оксидов может зависеть от различных факторов, таких как температура, давление и концентрация других растворенных веществ.
Кроме того, солеобразующие оксиды могут обладать специфическими физическими свойствами, такими как цвет и форма кристаллов. Например, оксид железа (III) имеет красный цвет, а оксид алюминия образует характерные шестигранные кристаллы. Такие свойства могут быть использованы для идентификации и различения различных солеобразующих оксидов.
Химические свойства солеобразующих оксидов

Солеобразующие оксиды металлов - это соединения, которые при взаимодействии с кислотами образуют соли и воду. Они обладают различными химическими свойствами, включая реакционную способность и способность к образованию кислотных или основных растворов.
Реакционная способность солеобразующих оксидов зависит от их валентности и электрохимического потенциала. Они могут проявляться в различных реакциях, таких как реакция гидратации, образование оснований или кислот, окисление или восстановление других веществ.
Способность формировать кислотные или основные растворы определяется наличием ионов водорода (H+) или гидроксидных ионов (OH-) в растворе. Солеобразующие оксиды металлов могут образовывать кислотные растворы (когда вода взаимодействует с оксидом металла и образуются оксоанионы) или основные растворы (когда вода взаимодействует с оксидом и образуются гидроксидные ионы).
Например, оксид натрия (Na2O) при взаимодействии с водой образует гидроксид натрия (NaOH), который является основанием. Оксид серы (SO3) при взаимодействии с водой образует кислоту серную (H2SO4), которая является кислотой.
Солеобразующие оксиды широко используются в химической промышленности и в лабораторных условиях для получения солей и проведения различных химических реакций. Они являются важными компонентами в производстве удобрений, стекла, керамики и других химических продуктов.
Основания, образуемые солеобразующими оксидами

Солеобразующие оксиды металлов могут образовывать основания – вещества, которые в растворе обладают следующими характеристиками:
- Образование гидроксидов: в результате реакции солеобразующих оксидов металлов с водой образуются гидроксиды, которые обладают щелочными свойствами. Например, оксид калия (K₂О) реагирует с водой, образуя щелочной гидроксид – гидроксид калия (KOH).
- Повышение pH раствора: основания, образованные солеобразующими оксидами, повышают концентрацию гидроксидных ионов в растворе, что приводит к повышению значения pH раствора. Высокое значение pH указывает на щелочные свойства основания.
- Нейтрализация кислот: основания обладают способностью нейтрализовать кислоты. При реакции основания с кислотой образуется соль и вода. Например, гидроксид натрия (NaOH) нейтрализует соляную кислоту (HCl), образуя соль хлорида натрия (NaCl) и воду.
Образование оснований является одним из важных свойств солеобразующих оксидов металлов. Основания широко используются в различных областях, например, в медицине, промышленности и сельском хозяйстве.
Применение солеобразующих оксидов в промышленности
Солеобразующие оксиды металлов, такие как оксид алюминия, оксид кальция, оксид магния и другие, имеют широкое применение в различных отраслях промышленности.
В производстве цемента солеобразующие оксиды играют ключевую роль. Они являются основными компонентами цементного компаунда и отвечают за его связующие и прочностные свойства. Оксиды металлов добавляются в соответствующем количестве при изготовлении цементного состава, что позволяет получить материал с определенной маркой и характеристиками.
Кроме того, солеобразующие оксиды применяются в производстве керамики и стекла. Оксид алюминия, например, используется в качестве основного компонента при производстве алюминиевых оксидных керамических изделий. Оксид магния используется в производстве огнеупорных изделий, таких как огнеупорные кирпичи и стальные литейные горшки.
Солеобразующие оксиды также находят применение в производстве металлов и сплавов. Они используются для получения специальных металлических материалов с необходимыми химическими и физическими свойствами. Например, оксид магния применяется при производстве сплавов никеля и кобальта, которые обладают высокой прочностью и жаростойкостью.
Одним из наиболее распространенных применений солеобразующих оксидов является использование их в качестве оснований. Оксид калия, оксид натрия и оксид кальция широко применяются в различных отраслях промышленности, в том числе в химической, пищевой и фармацевтической. Они используются для нейтрализации кислотных реакций, регулирования pH-уровня и образования солей при реакциях с кислотами.
Вопрос-ответ

Что такое солеобразующие оксиды металлов?
Солеобразующие оксиды металлов - это оксиды, которые образуют основания, или соли, при реакции с водой или кислотами.
Какие свойства имеют солеобразующие оксиды металлов?
Солеобразующие оксиды металлов имеют высокую реакционную активность и обладают щелочными свойствами. Они способны образовывать щелочные растворы при взаимодействии с водой и соли при реакции с кислотами.
Какие основания образуют солеобразующие оксиды металлов?
Солеобразующие оксиды металлов образуют основания, которые могут быть как растворимыми, так и нерастворимыми в воде. Растворимые основания могут полностью диссоциировать в воде, образуя гидроксиды металлов, а нерастворимые основания образуют осадок.
Какие металлы образуют солеобразующие оксиды?
Солеобразующие оксиды образуют различные металлы, включая алюминий, калий, натрий, магний и другие. Однако не все металлы образуют солеобразующие оксиды, некоторые образуют кислотные или амфотерные оксиды.
Какова роль солеобразующих оксидов металлов в химических реакциях?
Солеобразующие оксиды металлов играют важную роль в химических реакциях. Они являются основанием для реакции с кислотами, образуя соли. Также они могут использоваться в производстве различных продуктов, включая удобрения, стекло и красители.
