Химические реакции между солями металлов и ионами металлов являются одним из основных процессов в химии. В химической реакции происходит взаимодействие между атомами и молекулами веществ, в результате которого образуются новые вещества. Соль металла и соль другого металла в ионной форме вступают в реакцию, образуя новые соединения и ионы.
Соль металла представляет собой химическое соединение, состоящее из ионов металла и ионов отрицательного радикала. Когда соль металла вступает в реакцию с солью другого металла в ионной форме, происходит обмен ионами между веществами. В результате этой реакции образуются новые соли и ионы, которые ранее не существовали.
Ионное уравнение представляет собой запись химической реакции, в которой указываются ионы, участвующие в реакции, и указываются их коэффициенты. Ионное уравнение позволяет понять, какие ионы взаимодействуют между собой и какие новые вещества образуются в результате реакции.
Примером химической реакции солей металлов и солей других металлов может служить реакция между хлоридом натрия (NaCl) и серной кислотой (H2SO4). В результате реакции образуются хлорид серебра (AgCl) и серный ангидрид (SO3).
В заключение, химические реакции между солями металлов и ионами металлов являются важной составляющей химических процессов. Они позволяют получать новые вещества и изучать свойства различных химических соединений. Ионное уравнение является инструментом для записи и анализа химических реакций солей металлов и солей других металлов в ионной форме.
Химические реакции солей металлов

Химические реакции солей металлов являются основой для многих промышленных процессов и имеют широкое применение в научных исследованиях. В таких реакциях происходит обмен ионами между различными солями металлов, что приводит к образованию новых соединений.
Одной из наиболее известных таких реакций является реакция между солью металла и солью другого металла в ионной форме. Ионные уравнения позволяют описать этот процесс подробно. Например, реакция между растворимыми солями меди и железа может привести к образованию осадка зеленого цвета, представляющего собой соединение меди и железа.
Для проведения химических реакций солями металлов необходимо соблюдать определенные условия, такие как правильное соотношение между реагентами, температура и pH среды. Также важно учитывать совместимость металлов, чтобы избежать нежелательных побочных реакций. Реакции солей металлов могут быть как экзотермическими (с выделением тепла), так и эндотермическими (с поглощением тепла).
Изучение химических реакций солей металлов имеет большое значение для развития различных отраслей науки и техники. Эти реакции позволяют получить новые материалы и соединения, которые имеют различные свойства и применяются в различных отраслях промышленности, например, в производстве лакокрасочных материалов, электроники, катализаторов и других материалов.
Соль металла и соль другого металла

Химические реакции между солью одного металла и солью другого металла являются важным объектом изучения в химии. Такие реакции позволяют получать новые соединения на основе металлов и определять их свойства.
В процессе реакции соль одного металла растворяется в воде, образуя ионы металла и анионы. Аналогично, соль другого металла также диссоциирует. Затем происходит обмен ионами между растворами, что приводит к образованию новых ионных связей и образованию осадка или нового раствора.
Для записи ионного уравнения реакции используется сокращенная форма записи, где ионы веществ обозначаются символами и их зарядами. Реакция записывается в виде ионной схемы, где ионы указываются в виде вертикальных столбцов.
Ионные реакции между солями металлов позволяют изучать химические свойства новых соединений и определять их структуру и состав. Также такие реакции имеют практическое применение, например, в процессе синтеза и получения новых материалов, в качестве катализаторов и в других областях химии и материаловедения.
Ионная форма солей металлов

Ионная форма солей металлов – это химическая формула, в которой представлены ионы металла и анионы, соединенные в кристаллической решетке. В ионной форме соли металла медленно растворяются в воде, выделяя ионы металла и ионы аниона. Для каждого металла и соответствующего аниона существует своя уникальная ионная формула.
Ионная форма солей металлов играет важную роль в химических реакциях. При взаимодействии соли металла с другой солью в ионной форме происходят различные реакции, в результате которых образуются новые соединения.
Например, при взаимодействии соли металла А с солью металла В в ионной форме, могут образоваться новые соединения в виде осадка или раствора. Это зависит от сочетания ионов металлов и соотношения их концентрации.
Иногда ионная форма солей металлов может быть представлена в виде ионного уравнения. Ионное уравнение позволяет более точно описать процесс взаимодействия ионов металлов с ионами анионов.
В общем виде ионное уравнение для взаимодействия соли металла А с солью металла В может выглядеть следующим образом:
| Соль металла А | Соль металла В | Конечные продукты |
|---|---|---|
| Ион металла А | Ион металла В | Новое соединение |
В результате химической реакции образуются новые соединения, которые могут иметь различные свойства и применения.
Ионное уравнение химической реакции

Ионное уравнение химической реакции представляет собой запись реакции в ионной форме. Оно позволяет выразить изменение состояния вещества в ходе реакции и отследить образование и исчезновение ионов.
Для составления ионного уравнения необходимо знать химический состав ионов, которые участвуют в реакции. Коэффициенты перед ионами в уравнении обозначают их количество, учитывая закон сохранения массы.
Ионное уравнение химической реакции можно составить, например, для реакции между солью металла и солью другого металла в ионной форме. В этом случае, ионы одного металла замещают ионы другого металла в соли, образуя новые соединения.
Примером может служить реакция между раствором хлорида железа и раствором сульфата меди. Ионное уравнение данной реакции будет выглядеть следующим образом:
FeCl2 + CuSO4 → FeSO4 + CuCl2
В данном случае, ионы железа и меди меняются местами, образуя хлорид меди и сульфат железа. Однако, следует отметить, что ионное уравнение не показывает физическое состояние веществ и не учитывает поглощение или выделение энергии в ходе реакции.
Химические свойства солей металлов
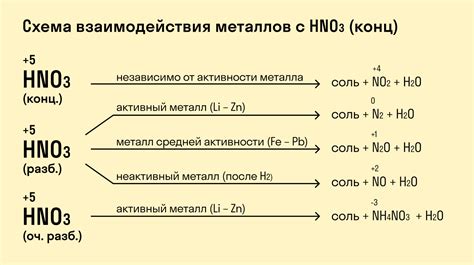
Соли металлов – это химические соединения, образованные в результате реакции между кислотами и металлическими оксидами, гидроксидами или карбонатами металлов. Они обладают рядом уникальных химических свойств, которые определяют их роль в многих процессах.
Прежде всего, соли металлов обладают высокой степенью растворимости в воде. Это позволяет им легко диссоциировать на ионы в растворе, что делает их доступными для взаимодействия с другими веществами. Благодаря этому, соли металлов активно используются в лабораторной и промышленной химии для проведения различных реакций.
Еще одним важным свойством солей металлов является их способность проявлять кислотные или щелочные свойства. Реакция солей металлов с водными растворами кислот или щелочей приводит к образованию соответствующих солей и воды. Это свойство является основой для проведения реакций нейтрализации и синтеза новых соединений.
Не менее важным является способность солей металлов образовывать кристаллические решетки в твердом состоянии. Большинство солей образуют регулярные кристаллические структуры, которые обладают определенными формами и свойствами. Это свойство делает соли металлов востребованными материалами для изготовления кристаллических приборов, например, в оптике и электронике.
Кроме того, соли металлов могут обладать другими химическими свойствами, такими как флюоресценция, магнитные свойства или окрашивание пламени. Эти особенности делают соли металлов интересными объектами для научных исследований и позволяют им находить применение в различных областях науки и техники.
Применение солей металлов
Соли металлов являются важными химическими веществами, которые находят широкое применение в различных отраслях научных и промышленных областей. Их использование обусловлено их уникальными свойствами и способностью взаимодействовать с другими веществами.
Одним из основных применений солей металлов является их использование в качестве катализаторов. Катализаторы на основе металлических солей применяются в промышленных процессах для ускорения химических реакций и повышения эффективности процессов перевода веществ из одного состояния в другое.
Кроме того, соли металлов широко применяются в производстве пленок и красок. Их уникальные свойства позволяют создавать устойчивые и прочные покрытия на металлических поверхностях. Соли металлов также используются в процессе гальванизации, при котором на поверхность металла наносятся слои других металлов для защиты от коррозии и придания декоративных свойств.
В медицине соли металлов нашли свое применение в виде медикаментов. Некоторые металлические соли используются в качестве лекарственных препаратов для лечения определенных заболеваний и компенсации недостатка определенных металлов в организме. Однако для достижения максимальной эффективности и безопасности применения таких солей требуется проведение специальных исследований и контроля дозировки.
В заключение, соли металлов имеют широкое применение в различных отраслях науки и промышленности. Их свойства и возможности взаимодействия с другими веществами позволяют использовать их как катализаторы, создавать прочные покрытия на металлических поверхностях, а также применять в медицине для лечения и компенсации недостатка определенных металлов в организме. Такое разнообразие применений делает соли металлов незаменимыми химическими веществами в современном мире.
Вопрос-ответ

Какие химические реакции могут произойти при контакте соли металла и соли другого металла в ионной форме?
При контакте соли металла и соли другого металла в ионной форме может произойти реакция обмена. В этом случае ионы металла из одной соли могут замещать ионы металла из другой соли. В результате этой реакции образуются новые соли и металлы.
Возможно ли, чтобы при реакции между солью металла и солью другого металла в ионной форме образовался осадок?
Да, при реакции между солью металла и солью другого металла в ионной форме может образоваться осадок. Это происходит, когда образующаяся новая соль металла является нерастворимой в воде. Это осадок можно отфильтровать и использовать для дальнейших исследований или производства.
