Соединения щелочных металлов с галогенами представляют собой важный класс неорганических соединений, которые обладают высокой степенью нестабильности и химической активности. Основной причиной этого является наличие ионной связи между атомами щелочного металла и галогена.
Ионная связь - это привлекательное взаимодействие между положительно и отрицательно заряженными ионами, которое происходит благодаря силам электростатического притяжения. В соединениях щелочных металлов с галогенами щелочные металлы (например, литий, натрий, калий) являются ионными катионами, а галогены (фтор, хлор, бром, йод) - ионными анионами.
Особенностью соединений щелочных металлов с галогенами является их высокая реакционная способность и энергетическая нестабильность. Взаимодействие этих соединений с водой, кислородом и другими веществами приводит к быстрому окислительно-восстановительному реакциям, искрению и выделению большого количества тепла.
Щелочные металлы и галогены: ионная связь и особенности

Щелочные металлы и галогены являются классом элементов, которые образуют сильные ионные связи при взаимодействии. Ионная связь происходит на основе принципа электростатического притяжения между положительно и отрицательно заряженными ионами. В случае соединений щелочных металлов и галогенов, металлы отдают один электрон, становясь положительно заряженными ионами (катионами), а галогены принимают этот электрон, становясь отрицательно заряженными ионами (анионами).
Ионная связь между щелочными металлами и галогенами характеризуется высокой энергией связи, что делает соединения стабильными и прочными. Эта связь обладает свойствами, позволяющими легко образовывать ионные решетки. Также важно отметить, что ионное соединение обладает характерными физическими и химическими свойствами, такими как высокая точка плавления и кипения, хрупкость и светимость.
Особенностью соединений щелочных металлов и галогенов является их реактивность. Галогены, обладающие высокой электроотрицательностью, образуют с щелочными металлами стабильные ионные соединения. Кроме того, такие соединения обладают химической активностью и могут участвовать в реакциях с другими веществами, например в химических синтезах или при окислительно-восстановительных процессах.
Ионное соединение щелочных металлов и галогенов является базовым строительным блоком множества химических соединений. В морских водах и природных бассейнах можно найти их растворы, а также некоторые их соединения используются в медицине, науке, быту и промышленности. Щелочные металлы и галогены играют важную роль в многих областях науки и технологий, благодаря своим уникальным свойствам и способности образовывать стабильные ионные связи.
Щелочные металлы: определение и свойства
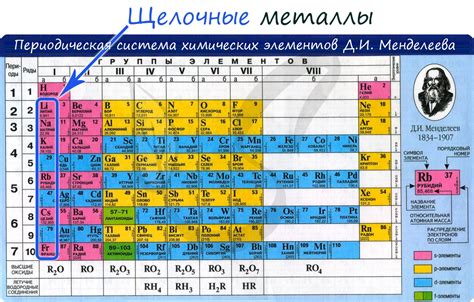
Щелочные металлы – это элементы химической группы I периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой химической активностью и образуют ионную связь с галогенами.
Первым щелочным металлом является литий – самый легкий металл, обладающий низкой плотностью и низкой температурой плавления. Следующие после него щелочные металлы – натрий, калий, рубидий, цезий и франций – также отличаются низкой плотностью и хорошей проводимостью электричества.
Физические свойства щелочных металлов связаны с их электронной структурой и металлическими свойствами. У них низкая температура плавления и кипения, а также высокая теплопроводность и электропроводность. Щелочные металлы характеризуются низкой твердостью и легкостью прессования.
Химические свойства щелочных металлов проявляются при взаимодействии с водой, кислородом и галогенами. Они реагируют с водой, образуя основания и выделяя водород. Возгонка щелочных металлов под водородом является опасным процессом. Кроме того, щелочные металлы активно окисляются на воздухе, образуя оксиды. Сочетание щелочных металлов с галогенами приводит к образованию ионной связи и образованию обедненных в электронах катионов металла и обогащенных электронами анионов галогена.
Галогены: общая характеристика и свойства

Галогены - это группа химических элементов, включающая в себя фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Они являются самыми активными неметаллами и имеют большой химический потенциал. Галогены находятся в 17-й группе периодической системы химических элементов и обладают 7 электронами во внешней оболочке. Это делает их склонными к взаимодействию с другими элементами для достижения стабильной восьмивалентной конфигурации.
У галогенов есть несколько общих свойств. Во-первых, они обладают высокой электроотрицательностью, что делает их сильными окислителями. Они способны отдавать электроны во время химических реакций. Во-вторых, они образуют стабильные двухатомные молекулы, такие как F2, Cl2 и Br2. Эти молекулы имеют характерный запах и цвет – Фтор ядовито-желтый, Хлор – зеленовато-желтый, Бром – красно-коричневый.
Галогены также могут образовывать ионные связи с другими элементами, включая щелочные металлы. При этом галогены получают отрицательный заряд, а металлы - положительный заряд. Ионные связи между галогенами и щелочными металлами являются очень сильными и обладают высокими температурами плавления и кипения. Такие двойные соединения между щелочными металлами и галогенами называются галогенидами щелочных металлов.
- Фтор и хлор обладают наибольшей реакционной активностью среди галогенов.
- Галогены также способны образовывать соединения с водородом, называемые галогидами водорода (HF, HCl, HBr, HI).
- Галогены широко используются в различных отраслях, включая химическую промышленность, медицину, производство пластиков и электронику.
Ионная связь между щелочными металлами и галогенами
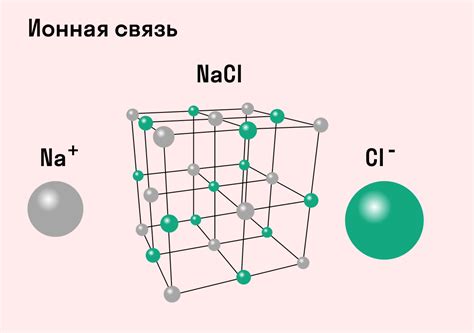
Щелочные металлы и галогены образуют соединения, в основе которых лежит ионная связь. Ионная связь - это тип химической связи, при которой образуются ионы положительного и отрицательного зарядов, которые притягиваются друг к другу силой электростатического взаимодействия.
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются группой элементов, которые имеют один валентный электрон. Галогены, такие как фтор, хлор, бром и йод, имеют валентность -1.
При образовании соединений между щелочными металлами и галогенами, щелочные металлы отдают свой валентный электрон галогену, образуя положительные ионы металла (катионы), а галогены принимают этот электрон, образуя отрицательные ионы (анионы).
Образовавшиеся ионы притягиваются друг к другу силой электростатического взаимодействия, что и создает ионную связь между щелочными металлами и галогенами. Эта связь является ковалентной только в отношении одного атома щелочного металла и одного атома галогена, в остальных случаях она ионная.
Особенности соединений щелочных металлов с галогенами
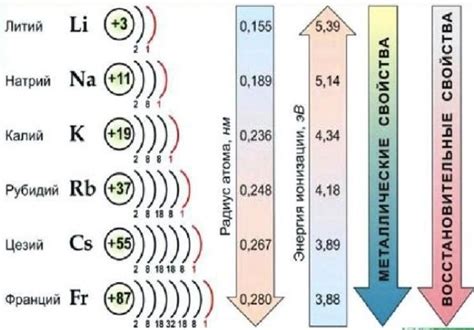
Соединения щелочных металлов с галогенами – это типичные примеры ионных соединений, образующихся между элементами периодической таблицы. Щелочные металлы (например, литий, натрий, калий) вступают в реакцию с галогенами (например, фтор, хлор, бром, йод) и образуют стабильные соединения, в которых щелочные металлы переходят в положительный ион, а галогены – в отрицательный ион.
Особенностью этих соединений является высокая энергия ионизации галогенов, что делает их сильными окислителями. В свою очередь, щелочные металлы обладают низкой электроотрицательностью и хорошо отдают электроны, что делает их сильными восстановителями.
Ионные связи в соединениях щелочных металлов с галогенами характеризуются межатомными силами притяжения между ионами разной полярности. Большая разность зарядов между ионами (положительный ион щелочного металла и отрицательный ион галогена) приводит к созданию сильного электростатического притяжения.
Соединения щелочных металлов с галогенами обычно имеют кристаллическую структуру, в которой ионы щелочных металлов и галогенов находятся в регулярной решетке. Это обуславливает множество свойств таких соединений, включая их высокую температуру плавления и кипения, а также их хрупкость и хорошую растворимость в воде.
Вопрос-ответ

Какова основная особенность ионной связи между щелочными металлами и галогенами?
Основной особенностью ионной связи между щелочными металлами и галогенами является образование кристаллических решеток, состоящих из положительно заряженных ионов металла и отрицательно заряженных ионов галогена.
Какие ионы образуются при соединении щелочных металлов и галогенов?
При соединении щелочных металлов (например, натрия, калия) с галогенами (например, хлором, бромом) образуются положительно заряженные ионы металла (Na+, K+) и отрицательно заряженные ионы галогена (Cl-, Br-).
Какие особенности имеют соединения щелочных металлов с галогенами?
Соединения щелочных металлов с галогенами имеют ряд особенностей. Во-первых, они образуют кристаллические решетки с простой структурой. Во-вторых, они обладают высокой температурой плавления и исключительной растворимостью в воде. Кроме того, они имеют высокую электропроводность и образуют белые или бесцветные кристаллы.
