Щелочные металлы представляют собой группу элементов периодической системы, которые характеризуются высокой реактивностью и металлическими свойствами. Эти элементы, включая литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), образуют разнообразные соединения с другими элементами, проявляющие уникальные химические и физические свойства.
Одним из ключевых аспектов изучения щелочных металлов является изучение их соединений и формул веществ, которые они образуют. Например, основной оксид лития имеет формулу Li2O, а оксид натрия обозначается формулой Na2O.
Соединения щелочных металлов широко используются в различных областях, таких как производство стекла, литий-ионные батареи, фармацевтическая промышленность и многое другое. Важно понимать, что знание формул веществ является неотъемлемой частью изучения щелочных металлов и их взаимодействия с другими элементами.
Изучение ключевых формул веществ, образуемых щелочными металлами, позволяет лучше понять их строение и свойства, а также развивать новые технологии и материалы на их основе.
Реакция щелочных металлов с водой

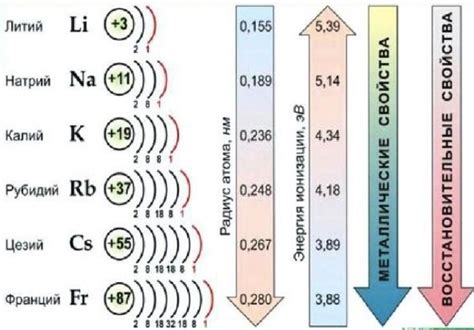
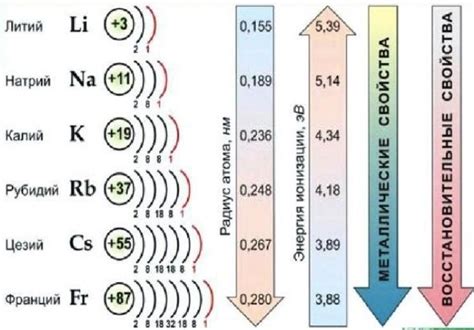
Щелочные металлы - это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. Они являются очень реактивными элементами, особенно в контакте с водой.
Реакция щелочных металлов с водой является одной из самых известных и опасных химических реакций. Эта реакция характеризуется выделением водорода и образованием гидроксидов щелочных металлов.
Процесс реакции начинается с того, что щелочный металл растворяется в воде, освобождая положительный ион и выделение гидроксида. Например, калий реагирует с водой по следующему уравнению:
2K + 2H2O → 2KOH + H2
В результате этой реакции образуется гидроксид калия(KOH) и выделяется водород(H2). Реактивность щелочных металлов с водой возрастает с ростом атомного номера, так как увеличивается размер атома и его электронная оболочка.
Важно отметить, что реакция щелочных металлов с водой проводится с осторожностью, так как водород, выделенный при реакции, обладает высокой взрывоопасностью. Поэтому в лабораторных условиях часто используются специальные меры предосторожности и наблюдатели.
Оксиды щелочных металлов и их свойства

Оксиды щелочных металлов - это химические соединения, образующиеся при реакции щелочных металлов (литая, натрия, калия, рубидия, цезия, франция) с кислородом. Они имеют важное значение как сырье для производства щелочей, стекла, керамики и других промышленных продуктов.
Свойства оксидов щелочных металлов обусловлены их химической структурой. Эти соединения обычно представляют собой кристаллические твердые вещества с высокой температурой плавления. Некоторые оксиды, такие как оксид лития (Li2O), обладают ионными связями, тогда как другие, например, оксид калия (K2O), имеют ковалентную связь.
Оксиды щелочных металлов обычно обладают щелочными свойствами и реагируют с водой, образуя соответствующие гидроксиды. Они также обладают высокой алкалистойчивостью и используются в качестве основы при обработке различных материалов. Оксид натрия (Na2O), например, широко применяется в химической промышленности для изготовления мыла, бумаги и других продуктов.
Отдельные оксиды щелочных металлов обладают также кислотными свойствами и могут реагировать с кислотами, образуя соли. Например, оксид калия (K2O) может реагировать с серной кислотой (H2SO4) и образовывать сульфат калия (K2SO4).
Суммируя, оксиды щелочных металлов являются важными химическими соединениями, которые имеют разнообразные свойства и активно применяются в различных отраслях промышленности. Изучение их свойств и взаимодействий позволяет более эффективно использовать эти соединения в производстве и находить новые способы их применения.
Гидроксиды щелочных металлов и их применение

Гидроксиды щелочных металлов – это соединения, которые образуются в результате реакции щелочного металла с водой. Ключевые формулы веществ таких гидроксидов включают LiOH, NaOH, KOH, RbOH и CsOH. Они обладают высокой щелочностью и способны растворяться в воде, образуя гидроксидные ионы.
Гидроксиды щелочных металлов имеют различные применения в разных областях. Например, NaOH, также известный как каустическая сода или щелочь, является важным промышленным химическим веществом. Он широко используется в процессе производства мыла, бумаги, стекла, текстиля и других материалов.
Кроме того, KOH, также известный как калиевая щелочь, является необходимым компонентом в производстве удобрений и биоэнергетики. Он также используется в производстве электролитов для аккумуляторов, электропроводящих растворов и других электротехнических девайсов.
Гидроксиды щелочных металлов также находят применение в аналитической химии и фармации. Эти соединения используются в химическом анализе для регулирования рН и осаждения металлов. Они также могут использоваться в качестве лекарственных препаратов для нейтрализации кислот и лечения различных заболеваний.
Итак, гидроксиды щелочных металлов – это важные химические соединения с широким спектром применения в различных отраслях промышленности, аналитической химии и медицине. Они играют важную роль в производстве различных материалов и химических продуктов, а также в аналитических и фармацевтических процессах.
Карбонаты щелочных металлов и их реактивность
Карбонаты щелочных металлов являются важными соединениями, которые широко используются в различных областях науки и промышленности. Они обладают особыми физическими и химическими свойствами, которые определяют их высокую реактивность.
Карбонаты щелочных металлов имеют общую формулу MCO3, где M обозначает любой щелочный металл, такой как литий, натрий, калий, рубидий или цезий. Эти соединения обычно являются белыми кристаллами или порошками с высокой растворимостью в воде.
Реактивность карбонатов щелочных металлов проявляется в их способности образовывать гидроксиды и оксиды при взаимодействии с кислородом или водой. Карбонаты щелочных металлов также могут распадаться при нагревании, образуя оксиды и углекислый газ.
Одной из важных реакций карбонатов щелочных металлов является их реакция с кислотами. При этом образуется соль и выделяется углекислый газ. Эта реакция широко используется в пищевой промышленности для приготовления различных продуктов, таких как газированные напитки или пекарские изделия, которые получаются благодаря выделению углекислого газа.
Карбонаты щелочных металлов также используются в процессе очистки воды и в производстве стекла, мыла и моющих средств. Благодаря своей реактивности, они способны взаимодействовать с другими химическими веществами и выполнять различные функции.
В заключение, карбонаты щелочных металлов являются важными соединениями, обладающими высокой реактивностью. Они находят широкое применение в различных областях и играют важную роль в нашем повседневном существовании.
Соли щелочных металлов и их использование
Щелочные металлы, такие как литий, натрий, калий и др., образуют различные соли, которые имеют широкое применение в различных областях.
Соли щелочных металлов находят применение в фармацевтической промышленности для создания лекарственных препаратов. Калий и натрий являются важными компонентами многих лекарственных средств, таких как анальгетики, антибиотики и средства для повышения иммунитета. Также соли щелочных металлов могут использоваться в качестве солевых растворов для инфузий и оральных растворов для регулирования электролитного баланса в организме.
Одно из самых широко известных использований солей щелочных металлов - это в производстве стекла. Литий, калий и другие щелочные металлы добавляются в стеклянную массу для улучшения ее свойств, таких как прозрачность, прочность и термическая устойчивость. Стекло с добавлением солей щелочных металлов используется во многих отраслях, включая автомобильную промышленность, электронику, строительство и медицину.
Соли щелочных металлов также используются в производстве удобрений. Например, калийные соли являются основным источником калия, который является одним из трех основных питательных веществ для растений. Удобрения на основе солей щелочных металлов позволяют увеличить урожайность культур и улучшить качество плодов и овощей.
Соли щелочных металлов также находят применение в производстве мыла и моющих средств. Натрий, калий и литий содержатся во многих моющих средствах благодаря своим моющим и пенящим свойствам. Эти соли помогают удалить грязь и жир с поверхностей, делая уборку более эффективной.
Вопрос-ответ

Какие основные свойства имеют соединения щелочных металлов?
Соединения щелочных металлов обладают рядом характерных свойств, таких как высокая степень ионизации, растворимость в воде, способность образования кристаллических решеток и слабое кислотное поведение.
Какие вещества входят в класс соединений щелочных металлов?
В класс соединений щелочных металлов входят такие вещества, как оксиды, гидроксиды, карбонаты, нитраты, сульфаты и другие. Они образуются в реакциях горения, обнаженных щелочей с кислородом воздуха и взаимодействии щелочей с кислотами.
Какие формулы веществ входят в класс соединений щелочных металлов?
В класс соединений щелочных металлов входят такие формулы веществ, как Na2O (оксид натрия), KOH (гидроксид калия), Li2CO3 (карбонат лития), Mg(NO3)2 (нитрат магния), CaSO4 (сульфат кальция) и многие другие.
