Щелочные металлы - это группа элементов периодической системы, состоящая из лития, натрия, калия, рубидия, цезия и франция. Они относятся к активным металлам и имеют широкое применение в различных областях науки и техники.
Одним из интересных аспектов, связанных с щелочными металлами, является их способность образовывать разнообразные соединения. Соединения щелочных металлов имеют ряд уникальных свойств и применяются в химической промышленности, медицине, электротехнике и других сферах деятельности.
В ходе урока по химии, ученики 9 класса изучат химические реакции, участвующие в образовании соединений щелочных металлов, и изучат их свойства. Они также смогут узнать о различных способах получения и применения соединений, а также охарактеризовать их структуры и основные особенности.
Для более наглядного представления материала, в процессе урока учитель может использовать видео, в котором показаны химические реакции образования соединений щелочных металлов. Это позволит ученикам лучше представить атомы и молекулы, увидеть, как происходят эти реакции и какие продукты образуются.
Такой урок по химии станет незабываемым и увлекательным для учеников, а также поможет им лучше понять характеристики и свойства соединений щелочных металлов. В результате ученики смогут применить свои знания на практике и решить различные химические задачи, связанные с данной темой.
Значение щелочных металлов в химии

Щелочные металлы – это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). В химии эти металлы играют важную роль и имеют множество значимых свойств и применений.
Первое их отличительное свойство – высокая реактивность. Щелочные металлы обладают наибольшими электроотрицательностями в своих периодах, что делает их очень химически активными. Они легко реагируют с водой, кислородом и другими неметаллами, образуя соединения.
Щелочные металлы широко используются в различных химических процессах и индустрии. Например, натрий применяется в производстве стекла, мыла и щелочного раствора. Калий применяется в производстве удобрений и в агротехнике. Литий используется в производстве литиевых батарей, а рубидий – в науке и высокоточных приборах.
Щелочные металлы также играют важную роль в биологии. Они являются необходимыми микроэлементами для живых организмов. Калий, например, участвует в регуляции водного и минерального балансов в организме. Натрий играет важную роль в работе нервной системы и мышц.
Выводя их из экономического и экологического значения, следует отметить, что щелочные металлы являются неотъемлемой частью химии и имеют широкий спектр применений. Изучение их свойств и реакций является важной составляющей химического образования и исследований.
Особенности свойств щелочных металлов
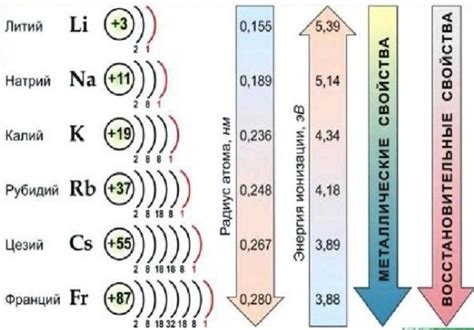
Щелочные металлы - это элементы, которые находятся в первой группе периодической системы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом особенностей, которые делают их уникальными и широко применяемыми в различных областях.
1. Активность
Щелочные металлы являются очень активными элементами. Они легко реагируют с водой, кислородом и другими веществами, образуя щелочные растворы и соединения. Например, литий reagiert с водой, выделяя водородный газ и образуя щелочную соль лиги.
2. Низкая плотность
У щелочных металлов низкая плотность, что делает их очень легкими. Наиболее легким из них является литий, который имеет плотность всего 0,53 г/см^3. Из-за этого свойства щелочные металлы очень хорошо плавают на поверхности воды.
3. Мягкость
Щелочные металлы являются мягкими и пластичными. Они легко ножом резать или расплющивать, а их мягкость можно увидеть на примере куска калия, который при небольшом давлении можно легко смять пальцами.
4. Цвет иллюминации
Одной из уникальных особенностей щелочных металлов является их способность излучать яркое свечение, когда они горят. Например, при поджигании кусочка лития, калия или натрия, возникает яркая пламенная эмиссия, которая привлекает внимание наблюдателя.
Таким образом, щелочные металлы обладают уникальными свойствами, которые делают их интересными для изучения и применения в различных областях науки и техники.
Как образуются соединения щелочных металлов

Соединения щелочных металлов образуются путем реакции этих металлов с другими веществами. Щелочные металлы включают натрий, калий, литий, цезий и рубидий. Они имеют высокую активность, поэтому легко вступают в химические реакции.
В основе образования соединений щелочных металлов лежит процесс ионизации. Щелочные металлы, такие как натрий или калий, отдают свой внешний электрон, образуя положительный ион.
Полученный положительный ион щелочного металла реагирует с отрицательным ионом другого вещества, образуя ионную связь. Например, натрий может реагировать с хлором, образуя хлорид натрия.
Соединения щелочных металлов могут образовывать не только ионные, но и ковалентные связи. В некоторых случаях щелочные металлы могут образовывать комплексные соединения, в которых металл образует связи с некоторыми лигандами.
Свойства соединений щелочных металлов
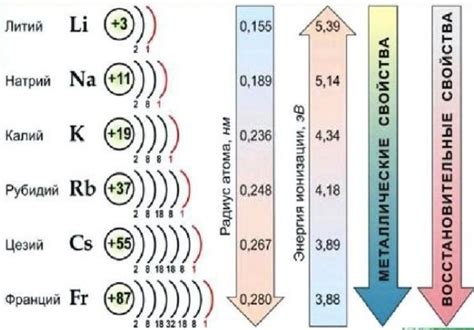
Соединения щелочных металлов обладают рядом характерных свойств, которые делают их уникальными и широко применяемыми в различных областях. Одним из основных свойств щелочных металлов является их высокая реакционная способность. Эти металлы легко реагируют с водой, кислородом, кислотами, неорганическими и органическими соединениями.
Еще одним характерным свойством соединений щелочных металлов является их способность образовывать соли. Солями называются соединения, в которых ионы металла ионов аниона образуют кристаллическую решетку. Такие соли обладают высокими температурами плавления и кипения, а также хорошей проводимостью электричества в расплавленном состоянии или в растворе.
Еще одним уникальным свойством щелочных металлов является их способность образовывать сплавы с другими металлами. Эти сплавы обладают измененными химическими и физическими свойствами, что позволяет использовать их в различных промышленных процессах и в производстве различных материалов.
Кроме того, соединения щелочных металлов обладают высокой теплопроводностью и электропроводностью, что делает их полезными в различных приложениях в электронике и энергетике. Они также хорошо растворяются в воде и образуют щелочные растворы, которые находят применение в различных химических процессах и технологиях.
Применение соединений щелочных металлов в жизни

1. Применение в промышленности: Соединения щелочных металлов широко используются в различных отраслях промышленности. Например, гидроксид натрия (NaOH), также известный как щелочь, используется в производстве стекла, мыла, бумаги, текстиля и других товаров. Кроме того, карбонаты щелочных металлов (например, карбонат натрия) используются в процессе газоудаления и при очистке воды.
2. Применение в электротехнике: Соединения щелочных металлов играют важную роль в электротехнике. Например, галогениды лития (LiI, LiBr) используются в электролитах для литий-ионных аккумуляторов. Эти аккумуляторы широко применяются в портативных электронных устройствах, таких как мобильные телефоны и ноутбуки, а также в электромобилях.
3. Применение в медицине: В медицине соединения щелочных металлов играют важную роль. Например, гидроксид калия (KOH) используется в процессе изготовления лекарственных препаратов и растворов для инъекций. Кроме того, лекарственные препараты, содержащие литий, применяются для лечения психических расстройств, таких как биполярное расстройство и депрессия.
4. Применение в сельском хозяйстве: Соединения щелочных металлов также находят применение в сельском хозяйстве. Например, гидроксид натрия используется в качестве прекурсора для производства различных удобрений, таких как нитрат натрия. Эти удобрения обогащают почву необходимыми питательными веществами и способствуют повышению урожайности растений.
5. Применение в испытательной лаборатории: Соединения щелочных металлов широко используются в испытательных лабораториях. Например, гидроксид натрия используется в качестве реагента для контроля pH в химических реакциях и в процессе анализа веществ. Кроме того, соли щелочных металлов (например, сульфат натрия) применяются в качестве стандартных реагентов для проведения химических и биохимических тестов.
Опасность использования щелочных металлов и их соединений

Щелочные металлы - это элементы периодической системы, такие как литий, натрий, калий, рубидий и цезий. Они обладают высокой химической активностью и встречаются в природе только в виде соединений.
Однако, несмотря на их важность в промышленности и науке, использование щелочных металлов и их соединений может быть опасным. Они обладают высокой реактивностью с водой и кислородом, что может привести к взрывам или пожарам.
Кроме того, щелочные металлы и их соединения могут вызывать серьезные повреждения кожи и глаз. Взаимодействие с кожей может вызвать ожоги, а попадание в глаза может привести к ослеплению или серьезной травме.
Также, несмотря на необходимость в использовании щелочных металлов в некоторых процессах, их неправильное хранение и утилизация могут представлять угрозу для окружающей среды. Выпуск большого количества щелочных металлов и их соединений в окружающую среду может вызывать загрязнение воды, почвы и воздуха.
В целях безопасности необходимо строго соблюдать правила использования и хранения щелочных металлов и их соединений. Необходимо использовать защитное снаряжение при работе с ними, такое как перчатки, защитные очки и халаты. Также рекомендуется проводить работы с щелочными металлами в специальных закрытых системах, чтобы избежать попадания вещества в окружающую среду.
Вопрос-ответ

Какие щелочные металлы существуют?
Существует несколько щелочных металлов, включая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Зачем изучать соединения щелочных металлов?
Изучение соединений щелочных металлов позволяет понять основные принципы химических реакций и взаимодействий между различными веществами. Кроме того, щелочные металлы находят широкое применение в промышленности и технологии, поэтому знание их свойств и связанных соединений важно для многих областей работы.
Какие свойства имеют соединения щелочных металлов?
Соединения щелочных металлов обладают несколькими характерными свойствами. Они обычно растворимы в воде и образуют щелочные растворы. Они также обладают высокой электропроводностью и могут образовывать ионные связи с другими элементами.
Какие соединения щелочных металлов используются в повседневной жизни?
Соединения щелочных металлов имеют широкое применение в повседневной жизни. Например, гидроксид натрия (NaOH), также известный как пищевая сода, используется в кулинарии и стирке. Натриевая соль (NaCl) является основным компонентом поваренной соли. Калий тиоцианат (KSCN) используется в медицине и фотографии. Это лишь некоторые примеры.
Какие опасности могут сопровождать работу с соединениями щелочных металлов?
При работе соединениями щелочных металлов необходимо соблюдать осторожность и принимать меры безопасности. Некоторые соединения могут быть ядовитыми или коррозионно активными. Например, гидроксид натрия (NaOH) может вызвать ожоги кожи и глаз, а карбид кальция (CaC2) может образовывать газ (ацид) ацетилин, который является взрывоопасным. Поэтому необходимо соблюдать инструкции и использовать соответствующие противоаварийные средства и средства защиты.
