Щелочноземельные металлы – это элементы химической группы 2 периодической системы, включающей бериллий, магний, кальций, стронций, барий и радий. Эти металлы обладают рядом уникальных свойств, которые делают их интересными и полезными элементами для использования в различных отраслях науки и технологий.
Соединения щелочноземельных металлов имеют широкий спектр применения, особенно в химической промышленности и науке. Они являются важными компонентами при производстве стекла, керамики, лекарственных препаратов, промышленных катализаторов и многих других материалов.
Выводы, получаемые из соединений щелочноземельных металлов, имеют большое значение для практического применения. Например, магниевые сплавы отличаются высокой прочностью и легкостью, что делает их идеальными материалами для авиационной и автомобильной промышленности. Также, соединения бериллия используются в изготовлении высоких технологических материалов, таких как цветные стекла и многие другие. Весьма интересными являются также исследования в области медицины, связанные с использованием радия в лечении раковых заболеваний.
Что касается химической реакции щелочноземельных металлов с другими веществами, то она может происходить с образованием осадков, солей и других соединений. Более того, некоторые соединения щелочноземельных металлов обладают люминесцентными и фосфоресцентными свойствами, что также открывает дополнительные перспективы их применения.
Соединения щелочноземельных металлов
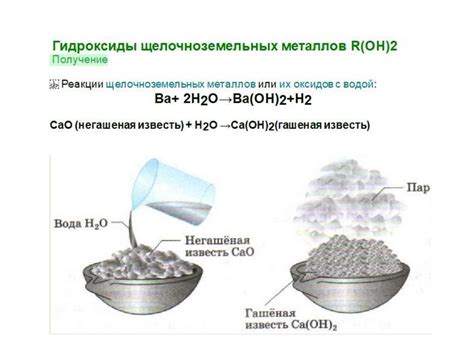
Щелочноземельные металлы – это группа химических элементов периодической системы, которые включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы характеризуются высокой активностью и образованием различных соединений.
Соединения щелочноземельных металлов могут быть представлены солями, оксидами, гидроксидами и другими соединениями. Они обладают различными свойствами и широко применяются в различных отраслях науки и техники.
Соли щелочноземельных металлов, такие как карбонаты, сульфаты и хлориды, широко используются в производстве стекла, керамики, удобрений, лекарственных препаратов и других продуктов. Они обладают высокой растворимостью в воде и образуют стабильные соединения с другими элементами.
Оксиды щелочноземельных металлов, такие как оксид бериллия (BeO), оксид магния (MgO) и оксид кальция (CaO), имеют высокую теплостойкость и используются в производстве керамики, огнеупорных материалов и многослойных пленок. Они проявляют сильные щелочные свойства и выполняют важную роль в множестве химических реакций и процессов.
Гидроксиды щелочноземельных металлов, такие как гидроксид магния (Mg(OH)2) и гидроксид кальция (Ca(OH)2), являются щелочными соединениями, используемыми в производстве цемента, пенообразователей и прочих материалов. Они обладают высокой растворимостью в воде и способностью к образованию гелеобразных структур.
Соединения щелочноземельных металлов играют важную роль в различных отраслях науки и техники и имеют широкий спектр применений. Их особенности и свойства делают их незаменимыми компонентами во множестве процессов и материалов.
Свойства и химический состав соединений щелочноземельных металлов и их вывод

Соединения щелочноземельных металлов, таких как бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba), обладают разнообразными свойствами и составом. Щелочноземельные металлы характеризуются высокой реактивностью и способностью образовывать стабильные соединения с различными элементами. Они имеют относительно низкую плотность, высокую температуру плавления и являются хорошими проводниками электричества.
Соединения щелочноземельных металлов находят широкое применение в различных отраслях промышленности и науке. Они используются в производстве стекла, керамики, лекарственных препаратов, пищевых добавок и силикатных материалов. Кроме того, эти соединения используются в качестве каталитических агентов, антиоксидантов и стабилизаторов пластиков. Их также можно найти в составе удобрений и горючих материалов.
Химический состав соединений щелочноземельных металлов может быть разнообразным. Они могут образовывать оксиды, гидроксиды, карбонаты, сульфаты, нитраты и другие соединения. Например, оксиды щелочноземельных металлов обладают высокой щелочностью, гидроксиды растворяются в воде и образуют щелочные растворы, а карбонаты можно найти в виде природных минералов, таких как кальцит и магнезит.
Выводы о свойствах и химическом составе соединений щелочноземельных металлов позволяют лучше понять их природу и возможности применения. Эти соединения играют важную роль во многих сферах нашей жизни, от промышленности до медицины, и постоянно исследуются для нахождения новых способов использования и улучшения их свойств.
Методы получения
Щелочноземельные металлы, такие как магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra), получаются различными методами в лабораторных условиях и промышленности.
Одним из основных методов получения щелочноземельных металлов является электролиз. В этом процессе раствор щелочноземельного галогенида (например, MgCl2) помещается в электролитическую ячейку. При подаче электрического тока на электроды, отрицательные ионы металла (Mg2+) переходят на катод, где возвращаются к нейтральному состоянию и осаждается металлический магний.
Другим методом получения щелочноземельных металлов является термическое восстановление их соединений. Например, для получения кальция, оксид кальция (известь) CaO, смешивают с алюминием и подвергают нагреванию. При этом происходит реакция восстановления, в результате которой образуется металлический кальций и оксид алюминия.
Также щелочноземельные металлы можно получить путем флюсового электролиза. В этом методе используется смесь галогенидов металла и его флюса (например, MgCl2 и LiCl). Под действием электрического тока происходит разложение галогенида, а флюс обеспечивает нормальное функционирование электролита и образование металла на катоде.
Кроме этих методов, существуют и другие способы получения щелочноземельных металлов, такие как редукционный метод с использованием коксующихся углей или металлургическими процессами с применением сырья, богатого соответствующим металлом.
Применение в промышленности

Соединения щелочноземельных металлов, такие как оксиды, гидроксиды, карбонаты, сульфаты и другие, широко применяются в различных отраслях промышленности.
Одним из основных применений щелочноземельных металлов является производство стекла. Оксиды и карбонаты щелочноземельных металлов используются в качестве основных компонентов стеклянной массы, которая при плавлении приобретает свойства прозрачности и прочности. Кроме того, гидроксиды щелочноземельных металлов используются в процессе обезжиривания стеклянных поверхностей перед нанесением защитных покрытий или клеевых соединений.
Еще одним важным применением щелочноземельных металлов является производство щелочных батарей. Щелочные элементы, такие как гидроксиды, карбонаты и оксиды щелочноземельных металлов, используются в электролите и анодах щелочных батарей. Эти элементы обеспечивают эффективное хранение и передачу электрической энергии, что делает щелочные батареи очень популярными в многих устройствах и электронных приборах.
Кроме того, соединения щелочноземельных металлов находят применение в производстве фармацевтических препаратов, косметических средств, красителей, катализаторов, а также в процессе очистки воды и водопроводных систем. Обладая антисептическими и антиоксидантными свойствами, эти вещества эффективно уничтожают вредные бактерии и вирусы, а также способствуют удалению загрязнений из воды.
Таким образом, применение соединений щелочноземельных металлов в промышленности широко разнообразно и охватывает множество отраслей, включая стекольную, электронную, фармацевтическую и химическую промышленности.
Способы переработки и утилизации

Соединения щелочноземельных металлов, такие как кальций, магний и стронций, являются важными компонентами в различных отраслях промышленности. Однако, после использования этих соединений их необходимо перерабатывать и утилизировать, чтобы минимизировать негативное воздействие на окружающую среду и извлечь максимальную пользу из этого процесса.
Одним из способов переработки и утилизации щелочноземельных металлов является их вторичное сырье. После использования соединений металлов они могут быть восстановлены и повторно использованы в производстве различных товаров. Например, кальций может быть использован в производстве цемента, магний - в производстве сплавов и легкосплавных материалов, а стронций - в производстве пиротехнических изделий.
Кроме того, соединения щелочноземельных металлов могут быть обработаны с целью извлечения полезных компонентов из них. Например, из кальция можно получить карбид кальция, который применяется в производстве ацетилена и в карбидных лампах. Из магния можно извлечь магниевую соль и использовать ее в производстве лекарственных препаратов. А стронций может быть использован для получения стронций-90, который используется в радионуклидной терапии и радиоизотопных исследованиях.
Кроме того, существуют специальные методы утилизации соединений щелочноземельных металлов, которые применяются для безопасной и экологически чистой обработки отходов. Например, соединения металлов могут быть подвергнуты физико-химической переработке, при которой из них выделяется ценное сырье и образуются безопасные отходы. Также существуют специальные методы обезвреживания и хранения отходов, чтобы предотвратить их негативное воздействие на окружающую среду.
В целом, переработка и утилизация соединений щелочноземельных металлов играет важную роль в обеспечении экологической устойчивости и устойчивого развития промышленности. Они позволяют максимально эффективно использовать ресурсы и минимизировать отрицательное воздействие на окружающую среду, что является неотъемлемой частью современного общества.
Вопрос-ответ

Какие элементы относятся к щелочноземельным металлам?
Щелочноземельными металлами называются металлические элементы второй группы периодической системы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
В чем особенность соединений щелочноземельных металлов?
Соединения щелочноземельных металлов обладают рядом особенностей: они имеют высокую термическую и химическую стабильность, хорошую электропроводность, могут образовывать соли с различными кислотами, обладают светоиндуцированными свойствами и широким спектром применения в различных отраслях промышленности.
