Металлы – это неотъемлемая часть нашей жизни, они присутствуют во многих предметах, с которыми мы ежедневно сталкиваемся. Одной из самых распространенных групп металлов являются металлы главных подгрупп, включающие металлы щелочных и щелочноземельных групп. Они обладают характерными свойствами, а также способностью образовывать соединения с различными элементами, включая хлор.
Соединения металлов с хлором являются важными веществами с точки зрения промышленной и научной деятельности. Они обладают различными свойствами и находят широкое применение в различных отраслях, включая химическую, металлургическую и электротехническую промышленности.
Одним из наиболее известных соединений металлов с хлором является хлорид натрия, или поваренная соль. Она широко используется в пищевой промышленности, а также в быту. Хлорид натрия обладает высокими антисептическими свойствами и используется для консервирования пищевых продуктов. Также он применяется как сжигательный катализатор, антипирин и окислитель при производстве различных химических соединений.
Взаимодействия металлов с хлором: названия и особенности

Взаимодействие металлов с хлором является важным аспектом химии и имеет множество применений в различных отраслях промышленности. Металлы могут образовывать соединения с хлором, которые имеют различные свойства и названия.
Одним из наиболее распространенных соединений металлов с хлором является хлорид. Хлориды металлов образуются при реакции металла с хлором или хлороводородной кислотой. Например, натрий образует натриевый хлорид (NaCl), который является основным компонентом поваренной соли.
Еще одним примером соединения металлов с хлором является хлорид железа (FeCl3). Этот соединение обладает особенной реакционной способностью и широко используется в качестве катализатора при различных химических превращениях.
Однако, не все металлы образуют стабильные хлориды. Некоторые металлы, такие как серебро и золото, не реагируют с хлором при обычных условиях. Однако, они могут образовывать соединения с хлором при повышенных температурах или в особых условиях.
Соединения металлов с хлором могут иметь различные физические и химические свойства. Некоторые хлориды металлов обладают высокой стабильностью и температурной устойчивостью, что позволяет им использоваться в высокотемпературных процессах. Другие хлориды металлов могут обладать различными цветами и использоваться в качестве красителей или пигментов.
Взаимодействия металлов с хлором представляют большой интерес не только с точки зрения промышленности, но и в научных исследованиях. Изучение свойств и реакций металлов с хлором помогает расширить наши знания о химических процессах и создать новые материалы с улучшенными свойствами.
Реакции металлов с хлором

Металлы имеют различную активность, и при взаимодействии с хлором происходят разнообразные реакции. Реактивность металлов с хлором зависит от их электрохимического потенциала и от температуры.
Некоторые металлы, такие как натрий, калий и литий, обладают высокой активностью и мгновенно реагируют с хлором. При контакте с хлором они сильно разогреваются и могут даже воспылать. Образуется соединение, которое имеет вид металлического хлорида.
Другие металлы, такие как железо и алюминий, медленно реагируют с хлором. Они первоначально образуют окислы, которые затем могут реагировать с хлором и образовывать хлориды. Например, когда железо реагирует с хлором, образуется хлорид железа, который имеет зеленоватый цвет.
Некоторые металлы, такие как серебро и золото, практически не реагируют с хлором при обычных условиях. Они могут образовывать хлористые соединения при воздействии хлора при высоких температурах или в определенных условиях.
При взаимодействии с хлором металлы могут образовывать различные соединения с различными свойствами. Некоторые хлориды металлов являются солями, которые широко используются в различных промышленных и химических процессах. Например, хлорид натрия (NaCl) является основным компонентом поваренной соли и используется в пищевой промышленности.
Образование хлоридов металлов
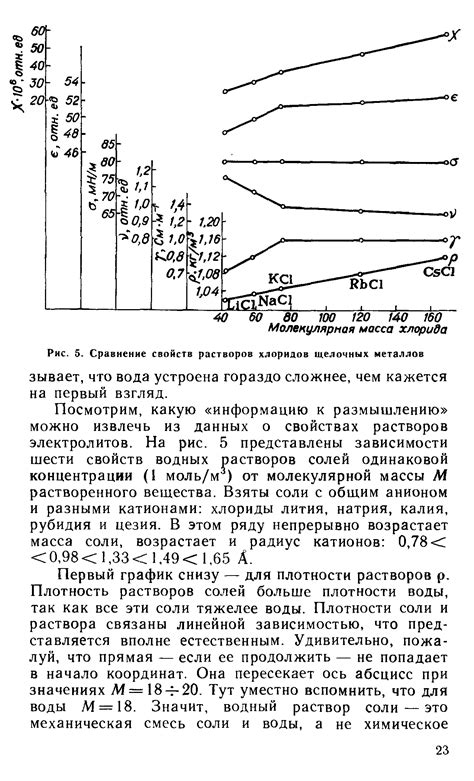
Хлориды металлов образуются в результате реакции металлов с хлором. Эта реакция происходит при нагревании или взаимодействии металла с хлористым газом. Образование хлоридов металлов является одной из важнейших реакций в неорганической химии.
Хлориды металлов обладают различными физическими и химическими свойствами. Некоторые хлориды металлов являются растворимыми в воде, другие - нерастворимыми. Растворимость хлоридов металлов зависит от их решеточной энергии и взаимодействия с молекулами воды.
Хлориды металлов обладают высокой степенью анизотропии. Это значит, что их физические свойства, такие как плотность и температура плавления, могут изменяться в зависимости от направления в решетке. Например, в кристаллах хлоридов металлов, атомы металла могут быть расположены в различных симметричных структурах.
Хлориды металлов обладают высокой электроотрицательностью, что делает их реактивными в химических реакциях. Они способны взаимодействовать с различными веществами и образовывать соединения с другими элементами, такими как кислород, сера, азот и другие.
Хлориды металлов имеют широкий спектр применения в различных областях. Например, хлориды некоторых металлов используются в производстве металлических сплавов, катализаторов, пигментов и других химических соединений.
Электронная структура хлорида металла
Хлорид металла представляет собой химическое соединение, состоящее из атомов металла и атомов хлора. Электронная структура хлорида металла определяется электронной конфигурацией атомов металла и хлора, а также их взаимодействием в соединении.
В металлических элементах электронная конфигурация обычно характеризуется наличием нескольких энергетических уровней, на которых находятся электроны. В свою очередь, атомы хлора имеют один энергетический уровень, на котором находятся электроны. В процессе образования хлорида металла происходит взаимодействие между валентными электронами атомов металла и атомов хлора.
В хлориде металла валентные электроны атомов металла переходят на энергетический уровень атомов хлора, образуя ионную связь между атомами. При этом атомы металла теряют электроны, превращаясь в положительно заряженные ионы, а атомы хлора получают электроны, превращаясь в отрицательно заряженные ионы.
Таким образом, электронная структура хлорида металла определяется числом электронов в валентной оболочке атомов металла и числом электронов на внешнем энергетическом уровне атомов хлора. Поэтому свойства хлорида металла, такие как проводимость электрического тока и теплопроводность, зависят от электронной структуры этого соединения.
Хлорирование металлов: способы и процессы

Хлорирование является одним из способов соединения металлов с хлором и находит широкое применение в различных областях науки и промышленности. Процесс хлорирования может осуществляться различными способами, в зависимости от конкретных задач и требований производства.
Одним из наиболее распространенных способов хлорирования металлов является химическое хлорирование, при котором металл взаимодействует с хлором в присутствии специальных реактивов. Этот метод позволяет получать разнообразные хлориды металлов, которые находят применение, например, в качестве антикоррозионных покрытий.
Другим способом хлорирования металлов является термическое хлорирование. Этот процесс осуществляется при высоких температурах, когда хлор вступает в реакцию с металлом в газообразной фазе. Результатом такого хлорирования являются хлориды металлов, которые могут быть использованы в производстве сплавов и других материалов.
Для некоторых металлов существует также электрохимическое хлорирование. В этом случае металлический предмет погружается в электролит, содержащий хлориды, и подвергается электролизу. В результате происходит электрохимическое хлорирование, при котором металл соединяется с хлором, образуя хлориды металлов на его поверхности.
Хлорирование металлов является важным процессом, который позволяет улучшить свойства материалов, придать им новые качества и обеспечить повышенную стойкость к коррозии. Знание способов и процессов хлорирования металлов позволяет эффективно использовать этот метод в различных областях науки и техники.
Химические и физические свойства хлоридов

Хлориды – химические соединения, образующиеся при взаимодействии металлов с хлором. Они обладают разнообразными химическими и физическими свойствами, которые определяют их поведение и применение в различных областях.
Одним из основных химических свойств хлоридов является их способность к растворению в воде. Большинство хлоридов растворяются в воде с образованием электролитических растворов, которые способны проводить электрический ток. Кроме этого, взаимодействие хлоридов с водой может сопровождаться образованием кислот или оснований.
Физические свойства хлоридов также разнообразны. Они могут быть как твердыми, так и жидкими веществами, а некоторые хлориды имеют даже газообразное состояние при комнатной температуре. Температура плавления и кипения хлоридов зависит от их химического состава и структуры молекул. Некоторые хлориды обладают высокой термической стабильностью, что делает их полезными в качестве катализаторов или веществ с высокой температурой плавления.
Особое значение имеют такие химические и физические свойства хлоридов, как реакционная способность и степень окисления. Хлориды способны участвовать во множестве химических реакций, включая окислительно-восстановительные процессы и образование соединений с другими элементами. Степень окисления хлорида может быть положительной или отрицательной, что влияет на его реакционную способность и возможные приложения.
Температурная зависимость реактивности металлов с хлором
Температура играет важную роль в реакции металлов с хлором, поскольку она влияет на скорость реакции и свойства получаемых веществ.
Некоторые металлы реагируют с хлором только при высоких температурах. Например, алюминий начинает реагировать с хлором только при температуре выше 550°C. При этом происходит образование алюминия хлорида (AlCl3). Другие металлы, такие как магний и цинк, реагируют с хлором уже при комнатной температуре.
Важно отметить, что при повышении температуры, реактивность металлов с хлором обычно увеличивается. Это связано с увеличением кинетической энергии молекул и атомов металла, что стимулирует их взаимодействие с хлором. Например, медь начинает активно реагировать с хлором при температуре около 400°C.
Однако некоторые металлы, такие как золото и платина, мало реагируют с хлором даже при высоких температурах. Это связано с их высокой стабильностью и низкой энергией активации для реакции с хлором. Эти металлы могут быть использованы в качестве катализаторов или защитных покрытий, поскольку они не подвержены коррозии хлором.
Токсичность и вредность хлоридов металлов
Хлориды металлов могут быть токсичными и вредными соединениями, способными нанести вред организму при контакте или потреблении. Разные хлориды металлов могут иметь различную степень токсичности и вредности в зависимости от своих свойств и концентрации.
Например, хлорид ртути (HgCl2) является одним из наиболее ядовитых хлоридов металлов. При попадании в организм, он может нанести вред нервной системе и почкам, вызвать остановку сердца и привести к смерти. Кроме того, хлорид ртути может быть поглощен через кожу и вызвать различные заболевания, такие как дерматиты и экземы.
Хлорид аммония (NH4Cl) также является химическим соединением, которое может быть потенциально вредным. При попадании в организм, он может вызвать раздражение слизистых оболочек, привести к проблемам с дыханием и даже вызвать химическое ожог или отек гортани.
Хлориды металлов, такие как хлориды железа, алюминия и меди, могут также быть токсичными в больших дозах. Они могут нанести вред органам и тканям, вызвать различные заболевания и нарушения в работе организма.
Выводя наружу токсичные хлориды металлов, организм расходует большое количество энергии, что может привести к ухудшению общего состояния организма и снижению его защитных функций.
Применение хлорирования металлов в промышленности

Хлорирование металлов – это процесс, в результате которого металлы обрабатываются хлором для получения особых свойств и улучшения их характеристик. Этот метод применяется в различных отраслях промышленности, таких как металлургия, электроника, автомобилестроение и другие.
Одним из основных применений хлорирования металлов является улучшение коррозионной стойкости материала. Хлорированные металлы обладают повышенной устойчивостью к агрессивным веществам, что делает их идеальными для использования в условиях, где есть высокий риск коррозии, например, при работе с кислотами или химическими реактивами.
Еще одним важным применением хлорирования металлов является улучшение механических свойств материала. Хлорирование позволяет увеличить твердость и прочность металла, что делает его более долговечным и устойчивым к воздействию внешних нагрузок. Такие металлы активно используются в производстве деталей и компонентов, которые должны выдерживать высокие нагрузки и повышенные температуры.
Также хлорирование металлов используется для создания специальных покрытий на поверхности металла. Эти покрытия обладают различными свойствами, такими как прозрачность, электропроводность, антибактериальность и другие. Они могут быть применены в электронике, оптике, медицине и других отраслях, где требуются материалы с определенными функциональными свойствами.
Таким образом, хлорирование металлов является важным процессом в промышленности, позволяющим значительно улучшить свойства и качество металлических материалов. Благодаря этому методу, металлы приобретают новые возможности применения и становятся более надежными, прочными и устойчивыми к воздействию различных факторов.
Вопрос-ответ

Какие металлы образуют соединения с хлором?
Множество металлов образуют соединения с хлором. Некоторыми из них являются натрий, калий, магний, алюминий, железо, медь, свинец, цинк и многие другие.
Каковы свойства соединений металлов с хлором?
Соединения металлов с хлором имеют различные свойства в зависимости от металла. Некоторые соединения являются прочными и стабильными, другие могут быть растворимыми в воде или иметь высокую температуру плавления. Некоторые соединения также обладают яркими цветами.
