Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются одной из самых изучаемых и важных групп элементов в химии. Их уникальные свойства и реактивность делают их основой для множества промышленных и научных приложений. В данной статье мы рассмотрим основные свойства и химические реакции щелочных металлов, а также их влияние на окружающую среду и человека.
Одной из характерных особенностей щелочных металлов является их низкая плотность и мягкость. Например, литий является самым легким металлом и имеет плотность всего 0,53 г/см³. Их мягкость делает их легко режущимися и податливыми для формования. Кроме того, щелочные металлы обладают низкой температурой плавления и кипения, что позволяет им быть жидкими при относительно низких температурах.
Основная причина реактивности щелочных металлов заключается в наличии всего одного электрона на внешней энергетической оболочке. Этот электрон легко отделяется при химических реакциях, что делает щелочные металлы сильными редуцирующими агентами. Они быстро окисляются воздухом, реагируют с водой с выделением водорода и ожоговидно взаимодействуют с кислотами. Будучи столь реактивными, щелочные металлы требуют особой осторожности при обращении с ними из-за высокой степени опасности для здоровья и безопасности.
Изучение свойств и реактивности щелочных металлов имеет большое значение не только в академическом смысле, но и с практической точки зрения. Благодаря своим уникальным химическим свойствам, щелочные металлы находят широкое применение в различных отраслях, включая батарейки, производство стекла, литье металлов, фармацевтическую промышленность и другие. Понимание их свойств помогает улучшить существующие технологии и разработать новые.
Свойства щелочных металлов и их важность в химии
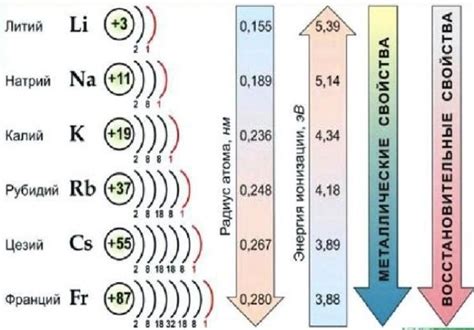
Щелочные металлы – это группа элементов, включающая литий, натрий, калий, рубидий, цезий и франций. У этих металлов есть ряд уникальных свойств, которые делают их важными в химии.
Одним из основных свойств щелочных металлов является их реактивность. Они легко взаимодействуют с водой, кислородом и многими другими веществами. Реакция щелочных металлов с водой может быть очень энергичной, с выделением водорода и образованием щелочного гидроксида.
Еще одним важным свойством щелочных металлов является их низкая плотность. Например, литий является самым легким металлом, имеющим плотность меньше, чем у воды. Это делает металлы этой группы особенно полезными для использования в легких и прочных конструкциях, а также в литий-ионных аккумуляторах.
Щелочные металлы также обладают способностью образовывать стабильные и растворимые соли, что делает их важными компонентами в химических реакциях. Они активно применяются в производстве оксидов, гидроксидов, хлоридов и других соединений, которые играют важную роль в различных отраслях промышленности и научных исследованиях.
В заключение, свойства щелочных металлов, такие как реактивность, низкая плотность и способность образовывать стабильные соли, делают их важными и универсальными веществами в химии. Они широко используются в различных отраслях промышленности и научных исследованиях, и играют важную роль в развитии современных технологий и науки.
Определение щелочных металлов

Щелочные металлы - это элементы, которые находятся в первой группе периодической таблицы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они также называются группой IA. Щелочные металлы отличаются высокой реактивностью и характеризуются определенными физическими и химическими свойствами.
Одним из основных свойств щелочных металлов является их низкая плотность. Например, литий имеет плотность всего 0,53 г/см3, а калий - 0,86 г/см3. Это делает эти металлы легкими и сравнительно мягкими, что облегчает их обработку и применение в различных областях, включая промышленность и медицину.
Щелочные металлы также обладают высокой электроотрицательностью и образуют положительные ионы (катионы) с единичным зарядом. В связи с этим они легко образуют ионы, снабжая окружающую среду положительными зарядами. Это помогает им в реакциях с другими элементами и соединениями, что делает щелочные металлы реактивными и способными к взаимодействию с большим количеством веществ.
Физические свойства щелочных металлов

Щелочные металлы представляют собой класс элементов периодической системы, включающий литий, натрий, калий, рубидий, цезий и франций. У этих металлов есть ряд характеристических физических свойств, которые делают их уникальными.
1. Мягкость и низкая плотность. Щелочные металлы характеризуются высокой мягкостью и низкой плотностью. Например, литий является самым легким металлом, а калий имеет плотность меньше, чем у воды.
2. Низкая точка плавления и кипения. Щелочные металлы имеют очень низкие температуры плавления и кипения. Например, калий плавится всего при 63 градусах Цельсия, что делает его жидким при комнатной температуре.
3. Хорошая теплопроводность. Щелочные металлы обладают хорошей теплопроводностью. Они способны эффективно передавать тепло при нагревании.
4. Высокая электропроводность. Щелочные металлы являются отличными проводниками электричества. Их электропроводность превосходит большинство других металлов и составляет основу для создания электронных устройств.
5. Реактивность. Щелочные металлы характеризуются высокой реактивностью. Они легко реагируют с кислородом, водой, галогенами и многими другими элементами и соединениями. Это свойство часто вызывает воспламенение или взрывы при взаимодействии с веществами.
В целом, физические свойства щелочных металлов делают их особенно важными для различных промышленных и научных приложений, а также для понимания основных принципов химии и физики.
Химические свойства щелочных металлов

Щелочные металлы – это группа элементов, которые находятся в первой группе периодической системы. Она включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы имеют ряд уникальных химических свойств, которые делают их непохожими на другие элементы.
Первое свойство, которое характеризует щелочные металлы, это их высокая реактивность. Они легко реагируют с водой, кислородом и многими другими веществами. Реакция с водой особенно интересна: щелочные металлы образуют гидроксиды, выделяя водород. К примеру, натрий реагирует с водой, образуя гидроксид натрия и выделяя водородный газ.
Второе свойство щелочных металлов - их низкая плотность. Щелочные металлы имеют малую массу в сравнении с другими элементами и способны плавать на поверхности воды. Например, кусочек металла калия будет плавать на воде и активно реагировать с ней, при этом выделяя газ.
Третье свойство щелочных металлов - образование оксидов. Щелочные металлы быстро окисляются на воздухе, образуя оксиды. Это из-за того, что они имеют один электрон во внешней оболочке, который легко отдается. Например, литий реагирует с кислородом из воздуха, образуя оксид лития.
Четвертое свойство связано с образованием солей. Щелочные металлы реагируют с кислотами, образуя соли. Например, щелочной металл натрий реагирует с хлоридной кислотой, образуя хлорид натрия.
В целом, химические свойства щелочных металлов делают их важными компонентами в химической промышленности, медицине и других областях. Их реактивность и способность образовывать соли позволяет использовать их в различных процессах и технологиях.
Важная роль щелочных металлов в химических реакциях

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, играют важную роль в химических реакциях благодаря своим уникальным свойствам.
Первое важное свойство щелочных металлов - высокая активность. Они являются наиболее активными металлами в периодической таблице и могут легко вступать в реакцию с другими веществами. Например, щелочные металлы реагируют с водой, соединениями кислорода и другими неорганическими и органическими соединениями.
Кроме того, щелочные металлы имеют низкую электроотрицательность, что делает их хорошими донорами электронов. Они легко отдают электроны, образуя положительно заряженные ионы. Это свойство является основой для многих важных реакций щелочных металлов, таких как реакции с кислородом, галогенами и водой.
Щелочные металлы также проявляют высокую аффинность к кислороду и образуют оксиды при взаимодействии с ним. Это свойство делает щелочные металлы эффективными реагентами при получении кислорода в промышленных процессах.
Важно отметить, что щелочные металлы отличаются от других металлов не только своей активностью, но и своей реакционной способностью в различных условиях. Например, литий более реакционноспособен, чем натрий, а калий более реакционноспособен, чем литий. Это связано с изменением радиуса и электроотрицательности атомов щелочных металлов.
Реактивность щелочных металлов
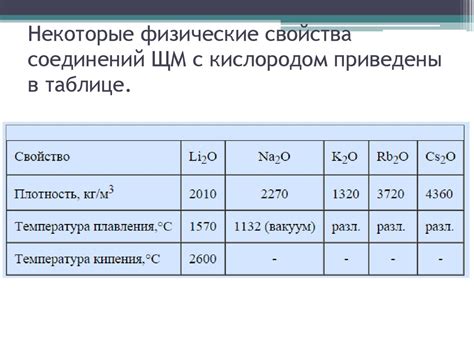
Щелочные металлы включают в себя элементы первой группы периодической таблицы: литий, натрий, калий, рубидий и цезий. Эти металлы характеризуются высокой реактивностью и активностью.
Реактивность щелочных металлов обусловлена их электрохимическими свойствами. Они обладают низкой электроотрицательностью и легко отдают свой внешний электрон, образуя положительные ионы. Это делает их хорошими веществами для образования ионных соединений.
Щелочные металлы реагируют с водой, образуя щелочные растворы и выделяя водород. При этом реакция проходит достаточно интенсивно, особенно с калием и натрием. При контакте с воздухом они активно окисляются, образуя оксиды и гидроксиды, что также свидетельствует о их высокой реактивности.
Реактивность щелочных металлов увеличивается с увеличением атомной массы элемента. Например, калий реагирует активнее натрия, а натрий активнее лития. Это связано с тем, что с увеличением атомной массы сила связи между электроном и ядром уменьшается, что упрощает процесс отдачи внешнего электрона.
Применение щелочных металлов в научных и промышленных областях

Щелочные металлы, такие как литий, натрий и калий, обладают рядом уникальных свойств, которые делают их незаменимыми в научных и промышленных областях. Они являются отличными проводниками электричества и тепла, что позволяет использовать их в производстве батарей, электродов и термоэлектрических устройств.
Еще одним важным применением щелочных металлов является их использование в производстве стекла и керамики. Литий используется в стекле для улучшения его химической стойкости и прозрачности, а калий применяется в качестве стабилизатора и прозрачного компонента в стекле.
Щелочные металлы также находят широкое применение в процессах синтеза органических соединений. Натрий и калий являются необходимыми реагентами при проведении множества химических реакций, таких как гидрирование, окисление и аминирование. Они также используются в качестве катализаторов при синтезе пластмасс, резин и других полимерных материалов.
Исключительная реакционная активность щелочных металлов позволяет использовать их в различных аналитических методах и диагностических тестах. Например, калий используется в фотометрических методах для определения содержания сахаров в пищевых продуктах, а литий - для определения уровня лития в крови и моче. Кроме того, щелочные металлы играют важную роль в медицине, используясь в процедурах диализа и лечения некоторых психических заболеваний.
В целом, применение щелочных металлов в научных и промышленных областях является неотъемлемой частью современных технологий и открывает широкий спектр возможностей для создания новых материалов, устройств и методов исследования.
Влияние щелочных металлов на окружающую среду

Щелочные металлы, такие как литий, натрий и калий, могут оказывать значительное влияние на окружающую среду. Они обладают высокой реактивностью и могут вызывать различные химические реакции и превращения веществ.
Взаимодействие щелочных металлов с водой является одним из наиболее характерных проявлений их реактивности. При контакте с водой щелочные металлы образуют щелочную среду с выделением водорода. Такие реакции могут вызывать опасность при неправильном обращении с этими металлами.
Щелочные металлы также выделяются в природной среде во время геологических процессов, таких как извержение вулканов и горно-промышленная деятельность. Высокое содержание щелочных металлов в почве может оказывать влияние на рост растений и формирование экосистем.
Опасность щелочных металлов заключается в их способности к реакциям с другими веществами, что может привести к образованию токсичных соединений. Кроме того, их неконтролируемое присутствие в окружающей среде может вызвать загрязнение почвы и воды, чем опасно для живых организмов и экологической стабильности.
В целом, подход к использованию щелочных металлов должен быть основан на строгом контроле и осторожности, чтобы минимизировать потенциальный негативный влияние на окружающую среду. Улучшение технологий и разработка экологически безопасных методов использования щелочных металлов могут сыграть важную роль в защите окружающей среды и обеспечении устойчивого развития.
Вопрос-ответ

Каковы свойства щелочных металлов?
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), обладают рядом характерных свойств. Во-первых, они являются мягкими и легкими металлами, что делает их относительно легкими в обработке. Они также имеют низкую плотность и низкую температуру плавления. Во-вторых, щелочные металлы очень активно реагируют с водой, образуя гидроксиды, и высвобождают водород. Они также реагируют с кислородом, образуя оксиды. Они также обладают высокой электроотрицательностью и формируют ионы с положительным зарядом.
Какие реакции могут происходить с щелочными металлами?
С щелочными металлами могут происходить различные реакции. Одной из наиболее известных реакций щелочных металлов является их реакция с водой. При взаимодействии с водой щелочные металлы образуют гидроксиды и высвобождают водород. Также щелочные металлы могут реагировать с кислородом, образуя оксиды. Они также реагируют с кислотами, образуя соль и высвобождая водород. Кроме того, щелочные металлы могут реагировать с неметаллами, образуя соединения, и с многими другими химическими веществами.
