Щелочные металлы являются элементами первой группы периодической таблицы и включают литий, натрий, калий, рубидий и цезий. Эти металлы характеризуются высокой химической активностью и находят широкое применение в различных областях, включая промышленность, энергетику и медицину.
Соединения щелочных металлов формируются путем образования ионных связей. Воздействие металлических атомов на молекулы неметаллов приводит к передаче электронов от металла к неметаллу, образуя ионы с положительным и отрицательным зарядами. Таким образом, щелочные металлы становятся катионами, а атомы неметалла - анионами. Именно эта электростатическая связь и обеспечивает прочность соединений щелочных металлов.
Важным особенностями соединений щелочных металлов является их высокая реакционность и способность образовывать структуры с ионной кристаллической решеткой. Именно благодаря этим свойствам, щелочные металлы используются в процессе синтеза различных соединений и материалов, а также в промышленных процессах, где требуется быстрая реакция или высокая электропроводность.
Однако существует и некоторые недостатки соединений щелочных металлов. Например, они обладают высокой химической реактивностью и взаимодействуют с влагой или кислородом из воздуха, что может вызывать их коррозию или взрывоопасность. Кроме того, соединения щелочных металлов могут проявлять токсические свойства и требовать особой осторожности в обращении.
В целом, соединения щелочных металлов представляют собой важные и широкоиспользуемые химические соединения, которые обладают рядом особенностей и свойств. Изучение их типов связи и особенностей позволяет лучше понять их химическую природу и использовать эти соединения в различных областях науки и промышленности.
Связь между щелочными металлами: тип связи и характерные особенности
Щелочные металлы в периодической системе химических элементов находятся в первой группе, включая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Связь между щелочными металлами характеризуется особым типом химической связи, которая называется металлической связью.
Металлическая связь является основной типом связи в металлах и объясняет их характерные свойства, такие как высокая теплопроводность и электропроводность, пластичность и металлический блеск. В металлической связи ионы щелочных металлов образуют кристаллическую решетку, где каждый ион окружен шествием электронов, образующих облако свободных электронов.
Электроны в кристаллической решетке металла могут свободно двигаться, что обеспечивает высокую электропроводность. Кроме того, свободные электроны способны перемещаться и передавать тепловую энергию, что обеспечивает высокую теплопроводность металлов.
Щелочные металлы также характеризуются низкой температурой плавления, что связано с слабостью и организацией их металлической решетки. Они образуют кристаллы с кубической симметрией, где атомы металла занимают углы куба и центры его граней. Кроме того, у этих металлов низкая твердость и высокая реактивность с водой и другими веществами.
Таким образом, связь между щелочными металлами представляет собой металлическую связь, которая обеспечивает высокую электропроводность, теплопроводность и другие характерные свойства металлов данной группы. Важно также отметить, что связи между щелочными металлами отличаются от связей в других группах элементов периодической системы, что определяет их уникальные химические и физические свойства.
Щелочные металлы: общие характеристики и свойства

Щелочные металлы - это группа элементов, которую составляют литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они названы так в связи с тем, что их окислы образуют щелочные растворы.
У щелочных металлов характерны определенные свойства. Во-первых, они являются очень реактивными, так как обладают одной электронной оболочкой внешнего слоя электронов. Поэтому они легко реагируют с водой, кислородом и другими веществами.
Во-вторых, щелочные металлы обладают низкой плотностью и низкой точкой плавления. Например, калий и натрий могут легко рассекать ножом благодаря своей мягкости.
Также эти элементы обладают высокой электропроводностью и ионизационными свойствами. Они способны образовывать ионы, влияющие на реактивность металлов.
Щелочные металлы находят широкое применение в различных отраслях промышленности. Например, литий используется в производстве легких сплавов и аккумуляторов, натрий - в стекольной и пищевой промышленности, а калий - в производстве удобрений. Благодаря своим уникальным свойствам, щелочные металлы представляют большой интерес для научных исследований и практического применения.
Ионная связь: основной тип связи между щелочными металлами
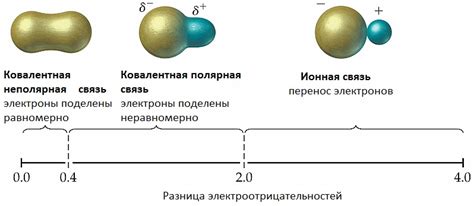
Щелочные металлы образуют ионные соединения, основанные на ионной связи. Ионная связь – это тип химической связи, возникающий между атомами, когда один из них отдает электроны, а другой принимает их. В ионных связях металлы отдают электроны, таким образом становясь положительно заряженными ионами, или катионами. В то же время неметаллы принимают электроны и образуют отрицательно заряженные ионы, или анионы. В результате образуются устойчивые структуры кристаллической решетки, в которых катионы и анионы образуют электростатические связи между собой.
Среди щелочных металлов особенно хорошо изучены соединения, образованные ионной связью, так как они являются наиболее простыми и хорошо кристаллизующимися. Ионная связь веществ, содержащих щелочные металлы, обусловлена их низкой электроотрицательностью и способностью катионных ионов щелочных металлов устраивать окружающие анионные ионы великой электростатической полярностью.
Чтобы сформировать ионы, щелочные металлы отдают один электрон, так как наружный электронный слой у них состоит из одного электрона. Потеря электрона приводит к тому, что следующие электронные слои и подобранное ядро предполагают положительный заряд, который покрывается ведомыми анионами отрицательными зарядами. В свою очередь, анионы, получив электрон от щелочных металлов, заполняют недостающие электроны в своих электронных слоях, становятся заряженными отрицательно и притягивают щелочные металлы своим новым электростатическим полем.
Влияние электронной оболочки на химическую активность щелочных металлов
Щелочные металлы, такие как литий, натрий и калий, обладают высокой химической активностью благодаря особенностям их электронной оболочки. Основным влияющим фактором на химическую активность щелочных металлов является наличие одного электрона во внешней оболочке.
Электронная конфигурация щелочных металлов имеет общую особенность - они имеют один электрон в s-орбитали внешней энергетической оболочки. Это означает, что они имеют большую готовность отдавать этот электрон, чтобы достичь более стабильной конфигурации. Такая способность делает щелочные металлы сильно реакционоспособными.
Щелочные металлы активно реагируют с водой, кислородом и другими химическими соединениями из-за этой высокой реакционной способности. Например, натрий, контактируя с водой, образует гидроксид натрия и выделяет водород. Калий, реагируя с кислородом, формирует оксид калия. При взаимодействии с аммиаком, щелочные металлы образуют амиды.
Электронная оболочка также оказывает влияние на физические свойства щелочных металлов. Например, они имеют низкую температуру плавления и кипения, что связано с слабыми взаимодействиями между атомами и ионами из-за отсутствия полностью заполненных p- и d-орбиталей.
Металлическая связь: особенности и значения для щелочных металлов

Щелочные металлы, такие как литий, натрий и калий, обладают особыми свойствами и играют важную роль в химии и технологии. Одной из важнейших характеристик щелочных металлов является их способность образовывать металлическую связь.
Металлическая связь - это тип химической связи, характерный для металлов, в котором положительно заряженные ионы металла окружаются облаком свободных электронов. Для щелочных металлов, таких как литий, натрий и калий, эти свободные электроны находятся во внешней электронной оболочке.
Особенностью металлической связи щелочных металлов является их низкая энергия ионизации. Это означает, что щелочные металлы легко отдают свои внешние электроны, образуя положительно заряженные ионы. Эти ионы образуют кристаллическую решетку, где электроны распределены равномерно и могут двигаться свободно.
Значение металлической связи для щелочных металлов заключается в их высокой электропроводности, теплопроводности и пластичности. Благодаря свободным электронам, щелочные металлы обладают способностью проводить электрический ток и тепло с высокой эффективностью. Они также обладают пластичностью, то есть способностью изменять форму без разрушения, благодаря свободному движению ионов в кристаллической решетке.
Итак, металлическая связь имеет особое значение для щелочных металлов, обеспечивая им высокую электропроводность, теплопроводность и пластичность, что делает их незаменимыми материалами в различных областях науки и промышленности.
Ковалентная связь: ограниченная роль для щелочных металлов
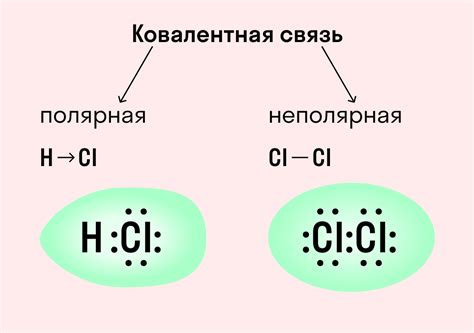
Щелочные металлы, такие как литий, натрий и калий, обладают низкими электроотрицательностями, что делает их типичными металлами сильно ионного связывания. Однако в некоторых случаях щелочные металлы могут образовывать соединения с характерной ковалентной связью.
Ковалентная связь вещественна для щелочных металлов, когда происходит взаимодействие их электронной оболочки с электронами других атомов. В основном это наблюдается в соединениях с атомами галогенов, так как эти элементы обладают высокой электроотрицательностью и способны "захватить" электроны щелочных металлов.
Ковалентная связь между щелочными металлами и галогенами проявляется в образовании молекулы с общей электронной структурой. Галогены, например, хлор, создают с щелочными металлами соединения, в которых образуется кристаллическая решетка. В этой решетке каждый ион щелочного металла окружен шестью ионами галогена. Такое взаимодействие оборачивается образованием кристаллической сети, состоящей из сильных ковалентных связей между атомами галогена и щелочных металлов.
Однако стоит отметить, что связь между щелочными металлами и другими элементами, не являющимися галогенами, в основном ионная, а не ковалентная. Это связано с тем, что взаимодействие электронной оболочки щелочных металлов с электронами других элементов не настолько сильно, чтобы образоваться кристаллическая решетка, как в случае с галогенами.
Особенности связи в специфических соединениях с щелочными металлами

Соединения с щелочными металлами, такими как литий, натрий, калий и другие, обладают рядом особенностей в связи, которые определяют их уникальные свойства и приложения.
Одной из основных особенностей связи в специфических соединениях с щелочными металлами является преобладание ионной связи. Щелочные металлы обладают низкой электроотрицательностью, что позволяет им легко отдавать свой валентный электрон. При образовании соединений с другими элементами, электроны щелочного металла переходят на другой элемент, образуя ионы с положительным зарядом. Это приводит к образованию ионных соединений с характерными колебаниями электрических зарядов.
Кроме того, в соединениях с щелочными металлами наблюдаются специфические эффекты, связанные с размерами ионов щелочных металлов. Щелочные металлы имеют большие ионы, что обусловлено их низкой электроотрицательностью и большим количеством электронов. Размеры ионов щелочных металлов влияют на такие характеристики, как координационное число, положение в ряду элементов, и их реакционную способность.
Еще одной особенностью связи в соединениях с щелочными металлами является их высокая реакционная способность. Щелочные металлы обладают большой энергией связи, что позволяет им активно взаимодействовать с другими веществами и участвовать во многих химических реакциях. Это делает их основными компонентами в различных промышленных и научных областях, таких как производство лекарств, электроника и энергетика.
Таким образом, соединения с щелочными металлами отличаются особыми свойствами связи, такими как преобладание ионной связи, влияние размеров ионов, и высокая реакционная способность. Это обуславливает их уникальные свойства и широкое применение в различных областях науки и технологии.
Вопрос-ответ

Какие типы связей присутствуют в соединении щелочных металлов?
Соединение щелочных металлов характеризуется наличием ионной связи между положительно заряженными ионами металла и отрицательно заряженными ионами, образованными отрицательными электронными оболочками. Также могут присутствовать ковалентные связи.
Какие особенности есть у такого соединения?
Одной из особенностей соединения щелочных металлов является их высокая реактивность, связанная с тем, что эти металлы имеют один валентный электрон и стремятся отдать его, образуя положительные ионы. Также щелочные металлы обладают низкой температурой плавления и кипения, хорошей проводимостью электричества и тепла, а также способностью образовывать легкие соединения с другими элементами.
Какие еще свойства имеют соединения щелочных металлов?
Соединения щелочных металлов обладают высокой растворимостью в воде, образуя гидроксиды, которые обладают щелочными свойствами. Также они способны образовывать соли, тугоплавкие оксиды и пероксиды, амфотерные оксиды. Кроме того, соединения щелочных металлов обладают высокой полярностью, что влияет на их физические и химические свойства.
Какие примеры соединений щелочных металлов вы можете привести?
Примерами соединений щелочных металлов являются гидроксиды (натриевая щелочь NaOH, калиевая щелочь KOH), сульфаты (натриевый сульфат Na2SO4, калиевый сульфат K2SO4), нитраты (натриевый нитрат NaNO3, калиевый нитрат KNO3) и другие.
