Щелочные металлы – это группа элементов, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы относятся к первой группе периодической системы и характеризуются высокой реактивностью и способностью образовывать ионные соединения.
Соединения щелочных металлов могут иметь различные свойства и особенности. Одной из основных особенностей щелочных металлов является их способность образовывать оксиды, гидроксиды и соли. Например, литий может образовывать соединения с кислородом (оксиды) и водой (гидроксиды), такие как литийоксид (Li₂О) и литийгидроксид (LiOH).
Соединения щелочных металлов также обладают высокой электропроводностью, что делает их полезными в различных областях науки и промышленности. Например, натрий используется в производстве стекла и очистке металлов, а калий является важным элементом для нормальной работы организма человека.
Таблица соединений щелочных металлов позволяет систематизировать и изучать их свойства. В ней указывается формула соединения, его название и основные характеристики. Так, соединение натрия с кислородом имеет формулу Na₂О и называется натрийоксидом. Это белый кристаллический порошок, разлагающийся при нагревании и растворяющийся в воде.
Важность изучения соединений щелочных металлов

Изучение соединений щелочных металлов является важным этапом изучения химии в 9 классе. Щелочные металлы, такие как литий, натрий и калий, являются одними из основных элементов Периодической системы и широко распространены в природе.
Знание свойств и особенностей соединений щелочных металлов позволяет учащимся лучше понять химические реакции и взаимодействия, происходящие с данными элементами. Соединения щелочных металлов обладают рядом характерных свойств, таких как высокая активность, способность к образованию солей и осаждения оснований.
Изучение соединений щелочных металлов также имеет большое практическое значение. Натрий и калий широко используются в промышленности для производства щелочей и органических соединений. Литий в свою очередь находит применение в аккумуляторах и лекарственных препаратах.
Важность изучения соединений щелочных металлов заключается также в их применении в повседневной жизни. Многие бытовые продукты, такие как мыло, стекло и средства питания, содержат соединения щелочных металлов. Понимание их свойств и реакционной способности позволяет более осознанно и безопасно использовать данные продукты в быту.
Щелочные металлы и их химические свойства
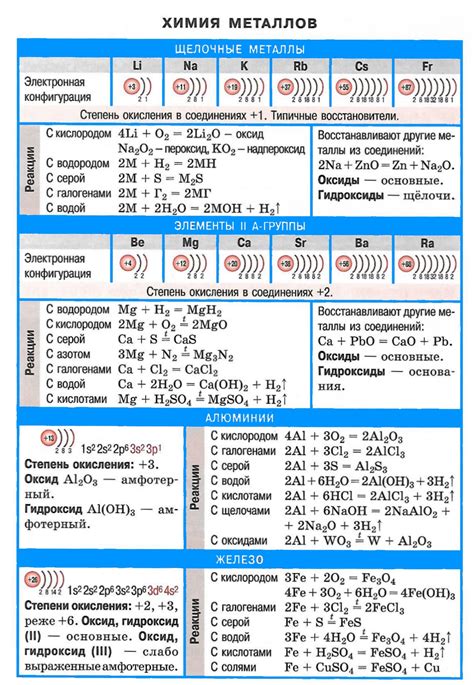
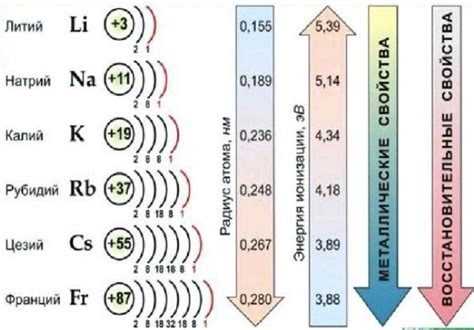
Щелочные металлы - это элементы, принадлежащие к первой группе периодической таблицы. Они включают литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы отличаются высокой активностью и реактивностью.
Основные свойства щелочных металлов:
- Мягкость. Щелочные металлы являются мягкими и легко деформируются при небольшом давлении.
- Низкая плотность. Они обладают очень низкой плотностью, что делает их самыми легкими металлами.
- Высокая реактивность. Щелочные металлы активно реагируют с водой, кислородом и другими веществами.
- Низкая температура плавления. Они имеют низкую температуру плавления, что позволяет им быстро расплавляться при нагревании.
Химические свойства щелочных металлов определяют их способность образовывать щелочные оксиды и гидроксиды. Например, литий образует гидроксид лития, NaOH - гидроксид натрия, KOH - гидроксид калия. Гидроксиды щелочных металлов широко используются в промышленности, в химических экспериментах и в быту.
Также стоит отметить, что щелочные металлы образуют соли, которые характеризуются яркой окраской. Например, натрий образует хлорид натрия, KCl - хлорид калия, RbCl - хлорид рубидия. Благодаря этим свойствам щелочные металлы активно применяются в производстве красителей и пигментов.
Список щелочных металлов
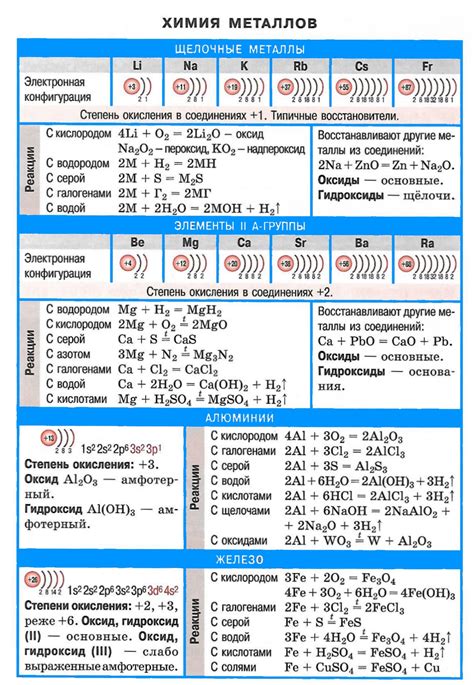
Щелочные металлы - это элементы, которые находятся в первой группе периодической системы. Всего в группе насчитывается шесть элементов: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются своими химическими свойствами и широко применяются в различных областях науки и промышленности.
Первый элемент списка - литий. Он обладает наименьшей атомной массой и наименьшим радиусом среди щелочных металлов. Литий используется в производстве аккумуляторов, лекарственных и химических препаратов, а также в ядерной энергетике.
Затем следует натрий, который широко распространен в природе, особенно в виде хлорида натрия (поваренная соль). Натрий используется в пищевой промышленности, производстве стекла, катализе реакций и других областях.
Калий - третий элемент списка. Он также присутствует в природе и используется в производстве удобрений, в пищевой промышленности, в медицине и других областях. Калий необходим для жизнедеятельности организма и регулирования водно-солевого баланса.
Рубидий и цезий являются редкими элементами и используются в научных исследованиях, а также в некоторых высокотехнологичных отраслях. Франций - самый редкий и нестабильный элемент группы, его свойства еще не полностью изучены.
Особенности химических свойств щелочных металлов
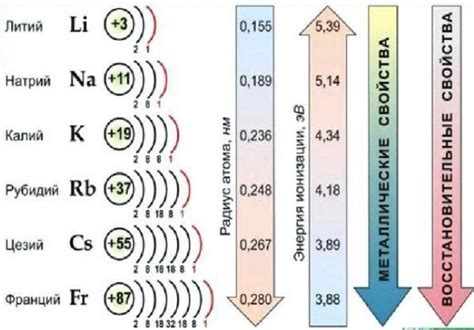
Щелочные металлы — это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У щелочных металлов есть ряд особенных химических свойств, которые делают их значимыми в области науки и технологий.
Высокая реактивность: Щелочные металлы обладают высокой реактивностью из-за того, что их внешняя электронная оболочка содержит только один электрон. Это делает их склонными к образованию ионов путем отдачи этого электрона. Именно поэтому щелочные металлы легко реагируют с водой, кислородом и другими веществами.
Образование щелочной среды: Когда щелочные металлы взаимодействуют с водой, они образуют гидроксиды, которые являются щелочными веществами. Гидроксиды щелочных металлов растворяются в воде, образуя гидроксид-ионы (OH-), что приводит к увеличению pH и созданию щелочной среды.
Пламенная реакция: Щелочные металлы, такие как натрий и калий, имеют способность гореть с ярким пламенем при контакте с воздухом. Это происходит из-за выделения энергии в процессе окисления, что делает их полезными в производстве фейерверков и пиротехнических изделий.
Электроотрицательность: Щелочные металлы обладают низкой электроотрицательностью, что делает их хорошими соединителями ионного типа. Они образуют ионы положительного заряда и легко реагируют с другими элементами, чтобы образовывать соли, оксиды и другие соединения.
Высокая активность в органической химии: Щелочные металлы также играют важную роль в органической химии. Они широко используются в процессе синтеза органических соединений, в качестве реагентов в реакциях замещения, а также в производстве лекарственных средств и катализаторов.
Химические уравнения соединений щелочных металлов
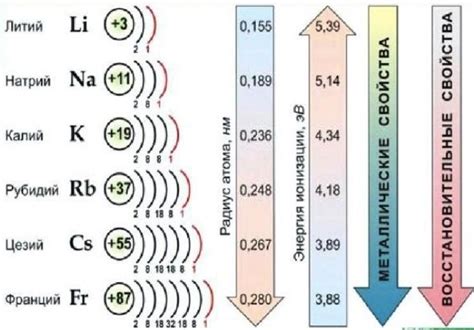
Щелочные металлы (либо щелочные элементы) группы 1 периодической системы химических элементов входят в состав соединений с различными элементами. Химические уравнения позволяют описать процессы образования данных соединений и изменения состояний веществ.
Например, реакция горения металла натрия (Na) приводит к образованию оксида натрия (Na2O). Химическое уравнение для данной реакции можно представить следующим образом:
4Na + O2 → 2Na2O
Реакция ионного обмена между металлом калия (K) и хлоридной кислотой (HCl) приводит к образованию хлорида калия (KCl) и выделению водорода (H2). Химическое уравнение для данного процесса записывается следующим образом:
2K + 2HCl → 2KCl + H2
Соединение гидроксида любого щелочного металла, например, гидроксида лития (LiOH), с кислотой, например, соляной кислотой (HCl), приводит к образованию хлорида соответствующего металла (например, хлорида лития - LiCl) и воды. Химическое уравнение для данной реакции будет иметь следующий вид:
LiOH + HCl → LiCl + H2O
Кроме того, щелочные металлы могут образовывать соединения с кислородом, непосредственно или через промежуточные вещества. Например, реакция металла калия (K) с водой (H2O) приводит к образованию гидроксида калия (KOH) и выделению водорода (H2). Химическое уравнение для этой реакции выглядит следующим образом:
2K + 2H2O → 2KOH + H2
Таким образом, химические уравнения позволяют описать различные реакции и образование соединений щелочных металлов, что позволяет лучше понять и изучить их свойства и химические составы.
Общее представление о химических уравнениях

Химическое уравнение – это символическое представление химической реакции, при которой происходят изменения веществ. В химических уравнениях показываются входящие и выходящие вещества, их коэффициенты и соотношения между ними.
Химическое уравнение состоит из двух частей: левой и правой сторон, разделенных знаком равенства. Левая сторона представляет собой реактивы – вещества, которые участвуют в реакции. Правая сторона содержит продукты реакции – вещества, образующиеся в результате химической реакции.
В химическом уравнении между реактивами и продуктами указываются коэффициенты. Они указывают количество вещества, участвующего в реакции. Коэффициенты позволяют соблюдать законы сохранения массы и энергии во время химической реакции.
Химические уравнения могут быть сбалансированными или несбалансированными. Сбалансированное химическое уравнение содержит равное количество атомов каждого элемента на обеих сторонах реакции. Для сбалансирования уравнения можно изменять только коэффициенты, не меняя формулы веществ.
Химические уравнения позволяют понять, какие вещества образуются в результате реакции, какие вещества потребляются и в каких количествах. Они являются важным инструментом для анализа и описания химических процессов.
Примеры химических уравнений соединений щелочных металлов
Натрий (Na) является представителем щелочных металлов и образует различные соединения. Например, реакция между натрием и хлором приводит к образованию хлорида натрия (NaCl). Химическое уравнение для этой реакции выглядит следующим образом:
2Na + Cl2 → 2NaCl
Щелочные металлы также образуют соединения с кислородом. Например, реакция натрия с кислородом приводит к образованию оксида натрия (Na2O). Химическое уравнение для этой реакции выглядит следующим образом:
4Na + O2 → 2Na2O
Калий (K) также образует различные соединения, включая хлорид калия (KCl) при реакции с хлором:
2K + Cl2 → 2KCl
Аммиак (NH3) также может вступать в реакцию с щелочными металлами, например, с натрием. Результатом такой реакции будет образование аммиаката натрия (NaNH2). Химическое уравнение для этой реакции выглядит следующим образом:
2Na + 2NH3 → 2NaNH2 + H2
Таким образом, щелочные металлы образуют различные соединения при взаимодействии с другими элементами, что позволяет им активно участвовать в различных химических реакциях.
Вопрос-ответ

Какие металлы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
На что особенно нужно обратить внимание при соединении щелочных металлов с другими веществами?
При соединении щелочных металлов с другими веществами особенно важно обратить внимание на реакции, которые могут протекать с образованием водорода (H2), газообразных оксидов и гидроксидов. Также следует учитывать, что щелочные металлы могут проявлять сильную химическую активность.
Какая таблица может помочь при изучении соединений щелочных металлов?
При изучении соединений щелочных металлов можно использовать таблицу растворимости и удаления анионов для определения реакций образования осадка и растворимости солей.
Какие свойства щелочных металлов определяют их способность образовывать соединения с другими веществами?
Способность щелочных металлов образовывать соединения с другими веществами определяется их низкой ионизационной энергией, большими радиусами и малой электроотрицательностью. Эти факторы позволяют щелочным металлам легко отдавать свои валентные электроны и образовывать ионы положительного заряда.
