Щелочные металлы представляют собой химическую группу элементов периодической таблицы, которая включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы обладают рядом общих свойств и реакций, которые делают их особенно интересными и важными в химии и технологии.
Первым свойством щелочных металлов является их активность. Они являются самыми активными металлами и легко реагируют с водой, кислородом и другими веществами. Когда щелочные металлы взаимодействуют с водой, они выделяются водород и образуют щелочные гидроксиды. Это свойство делает щелочные металлы важными компонентами в процессе производства щелочей и других химических соединений.
Другим важным свойством щелочных металлов является их мягкость. Они являются металлами мягкими, легко поддающимися формовке и растяжке. Из-за этого свойства щелочные металлы могут использоваться в различных промышленных процессах и производствах, например, в производстве алюминия, стали и других металлических изделий.
Также щелочные металлы имеют низкую плотность и низкую температуру плавления, что делает их полезными в применении в различных технологиях. Они также обладают высокой электропроводностью, что делает их важными в производстве электроники и аккумуляторных батарей.
В целом, свойства и реакции щелочных металлов делают их незаменимыми во многих областях науки и промышленности. Изучение и понимание их химических свойств и реакций имеет огромное значение для развития современных технологий и научных исследований.
Свойства щелочных металлов

Щелочные металлы - это группа элементов, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они имеют множество уникальных свойств, которые делают их полезными и важными элементами в нашей жизни.
Первое свойство щелочных металлов - это они очень реактивны. Они легко реагируют с водой, кислородом и другими элементами. Когда щелочные металлы реагируют с водой, они образуют щелочные растворы и выделяются водород. Это делает их хорошими источниками водорода для различных процессов.
Второе свойство щелочных металлов - это их низкая плотность. Они очень легкие и могут плавать на поверхности воды. Это делает их идеальными элементами для создания легких материалов, таких как алюминий. Кроме того, они являются важными компонентами вечных двигателей, так как они обладают высокими энергетическими свойствами и имеют высокую теплопроводность.
Третье свойство щелочных металлов - это их способность образовывать ионы. Щелочные металлы имеют одну внешнюю оболочку, которая легко отделяется от атома. Это позволяет им образовывать ионы с положительным зарядом и легко реагировать с другими элементами. Благодаря этой способности щелочные металлы используются для создания различных соединений.
- Первый щелочной металл - литий (Li).
- Второй щелочной металл - натрий (Na).
- Третий щелочной металл - калий (K).
- Четвертый щелочной металл - рубидий (Rb).
- Пятый щелочной металл - цезий (Cs).
- Шестой щелочной металл - франций (Fr).
Физические свойства щелочных металлов

Щелочные металлы – это химические элементы, принадлежащие к первой группе периодической системы. Они включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У всех этих металлов есть ряд общих физических свойств, которые делают их уникальными и интересными для исследования.
Первое физическое свойство щелочных металлов – низкая плотность. Щелочные металлы являются одними из наименее плотных металлов. Например, литий является наименее плотным металлом – его плотность составляет всего 0,53 г/см³. Вместе с низкой плотностью, щелочные металлы обладают также низкой температурой плавления и кипения, что делает их мягкими и легко плавящимися.
Второе физическое свойство щелочных металлов – химическая реактивность. Щелочные металлы очень активные химические элементы. Они реагируют с кислородом, водой, аммиаком и другими веществами, образуя различные соединения. Например, натрий при контакте с водой сильно реагирует, выделяя гидроген и образуя гидроксид натрия.
Третье физическое свойство щелочных металлов – металлический блеск. Щелочные металлы имеют характерный металлический блеск, который проявляется при свежем разрезе металла или его поверхности. Блеск щелочных металлов является следствием их способности отражать свет и проводить электрический ток.
Четвертое физическое свойство щелочных металлов – низкая жаропроводность. Щелочные металлы являются плохими проводниками тепла. Это означает, что они медленно передают тепло через свою структуру. За счет этого свойства щелочные металлы часто используются в изоляционных материалах, которые могут защитить от тепла и сохранить его при низких температурах.
Химические свойства щелочных металлов

Щелочные металлы – это элементы периодической системы, входящие в первую группу и обладающие сходными химическими свойствами. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Основными химическими свойствами щелочных металлов являются:
- Низкая ионизационная энергия: Щелочные металлы характеризуются низкой энергией, необходимой для удаления внешнего электрона из атома. Из-за этого они легко образуют положительные ионы, обладающие однозначным электрическим зарядом.
- Активность по отношению к воде: Щелочные металлы быстро реагируют с водой, образуя щелочные растворы и высвобождая водород. Под воздействием влаги они поверхностно окисляются, что приводит к образованию окислов металлов и электролитического разложения воды.
- Высокая реакционная способность: Щелочные металлы легко образуют соединения, вступают в реакции с большинством других веществ. Они сильные окислители и могут выступать в качестве реагентов при синтезе различных химических соединений.
- Образование окиси при взаимодействии с кислородом: Щелочные металлы образуют окиси, когда взаимодействуют с кислородом. Например, натрий при взаимодействии с воздухом образует оксид натрия (Na2O), который обладает щелочными свойствами и используется в производстве стекла и лекарственных препаратов.
- Образование солей: Щелочные металлы образуют соли при реакции с кислотами. Это основное химическое свойство, в основе которого лежит образование ионного связи между металлами и не-металлами.
- Образование сплавов: Щелочные металлы образуют сплавы с другими металлами, что позволяет им иметь широкое применение в металлургии и производстве различных материалов.
В целом, щелочные металлы обладают высокой химической активностью и ценными свойствами, что делает их незаменимыми во многих областях производства и научных исследований.
Кислотные свойства щелочных металлов

Щелочные металлы - группа элементов в периодической системе, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой реакционной способностью и образованием щелочных оксидов и гидроксидов. Щелочные металлы обладают кислотными свойствами, так как они могут реагировать с кислотами, образуя соли и воду.
Кислотные свойства щелочных металлов объясняются наличием свободного внешнего электрона в их валентной оболочке. Этот электрон может быть передан на водород ион кислоты, образуя водородный газ и ион металла. Например, реакция натрия с серной кислотой приводит к образованию соли натрия (Na2SO4) и водорода (H2).
Кислотные свойства щелочных металлов также проявляются при взаимодействии с неокисленными неметаллами, например, с кислородом. В результате образуется соединение, содержащее ион металла. Например, реакция калия с кислородом приводит к образованию оксида калия (K2O).
Щелочные металлы также проявляют кислотные свойства при растворении в воде. Они образуют гидроксиды, сильные основания, которые реагируют с водой, образуя ионы гидроксида и легко отдают этот ион в реакциях с кислотами. Например, гидроксид натрия (NaOH) реагирует с соляной кислотой (HCl) и образует соль (NaCl) и воду (H2O).
Образование гидроксидов щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, проявляют высокую активность по отношению к воде и образуют гидроксиды при контакте с ней.
Образование гидроксидов щелочных металлов является конкретной реакцией воды с металлическими ионами, приводящей к образованию щелочных растворов. Гидроксиды щелочных металлов имеют основные свойства и широко используются в промышленности и научных исследованиях.
Эта реакция идет следующим образом: металлический ион щелочного металла реагирует с молекулой воды, при этом металл окисляется, а молекула воды восстанавливается. В результате образуется гидроксид щелочного металла и выделяется водородный газ.
Например, реакция образования гидроксида натрия выглядит следующим образом: 2Na + 2H2O → 2NaOH + H2. Подобные реакции происходят и с другими щелочными металлами.
Гидроксиды щелочных металлов обладают щелочными свойствами и взаимодействуют с кислотами, образуя соли. Эти соединения играют важную роль в химических процессах, а также используются в производстве щелочных батарей, стекла, мыла и других продуктах.
Реакция щелочных металлов с кислородом и водородом

Щелочные металлы - это элементы, которые находятся в первой группе периодической системы. Они включают лицевой кремний, натрий, калий, рубидий, цезий и франций. Щелочные металлы обладают низкой плотностью и низкой температурой плавления, что делает их идеальными для различных промышленных и научных приложений.
При реакции щелочных металлов с кислородом образуются основные оксиды. Например, натрий при взаимодействии с кислородом образует оксид натрия (Na2O), который является белым кристаллическим веществом. Рубидий, в свою очередь, образует оксид рубидия (Rb2O), который тоже имеет белый цвет. Водородовые оксиды щелочных металлов (NaOH, KOH и т. д.) известны как гидроксиды и широко используются в различных промышленных процессах.
Реакция щелочных металлов с водородом также не протекает без изменений. В результате взаимодействия щелочных металлов с водородом образуются гидриды металлов. Например, натрий при взаимодействии с водородом образует гидрид натрия (NaH), который представляет собой белое кристаллическое вещество. Калий, рубидий и цезий также образуют соответствующие гидриды при реакции с водородом.
Реакции щелочных металлов с кислородом и водородом являются важными и хорошо изученными процессами, которые позволяют получить различные соединения металлов. Эти соединения широко применяются в химической и фармацевтической промышленности, а также в научных исследованиях.
Реакция щелочных металлов с галогенами
Галогены - это элементы группы 17 периодической системы, включающие фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Они характеризуются высокой электроотрицательностью и стремлением к получению одного электрона для заполнения внешней оболочки.
Реакция щелочных металлов с галогенами является одной из самых характерных и важных в химии. При взаимодействии щелочных металлов с галогенами образуются соли щелочных металлов - галогениды.
В реакциях с галогенами щелочные металлы проявляют высокую реакционную активность, так как стремятся отдать один электрон и образовать положительный ион. Галогены, в свою очередь, стремятся получить один электрон и образовать отрицательный ион.
Реакция щелочных металлов с галогенами протекает с выделением большого количества энергии и образованием ионов галогенида щелочного металла:
| Реакция | Уравнение |
|---|---|
| Реакция натрия с хлором | 2Na + Cl2 → 2NaCl |
| Реакция калия с бромом | 2K + Br2 → 2KBr |
| Реакция лития с йодом | 2Li + I2 → 2LiI |
Соли щелочных металлов - галогениды имеют характерные физические свойства, такие как высокая температура плавления и соль распознается по яркому окрашиванию пламени в специфический цвет.
Реакция щелочных металлов с галогенами является важной для получения солей щелочных металлов, которые широко используются в различных областях, включая медицину, производство стекла, химическую промышленность и др.
Реакция щелочных металлов с кислотами и основаниями

Щелочные металлы - это группа элементов периодической системы, который включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все они являются мягкими металлами и обладают высокой реактивностью.
Реакция щелочных металлов с кислотами происходит с образованием соли и выделением водорода. Например, когда натрий реагирует с соляной кислотой (HCl), образуется соль - хлорид натрия (NaCl) и выделяется водородный газ (H2).
Реакция щелочных металлов с основаниями также протекает с образованием соли и выделением воды. Например, реакция натрия с гидроксидом натрия (NaOH) приводит к образованию соли - натрия гидроксида (NaOH) и выделению воды (H2O).
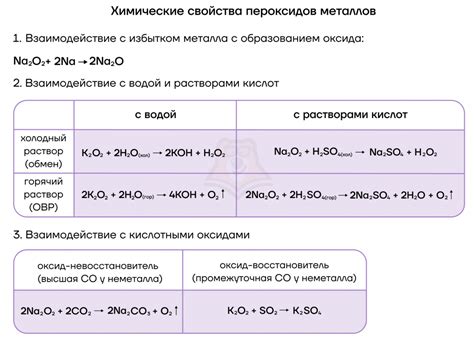
Щелочные металлы проявляют повышенную реактивность иной раз и при взаимодействии с воздухом. Они быстро окисляются и образуют оксиды, например, оксид натрия (Na2O) или пероксид натрия (Na2O2). Оксиды щелочных металлов обладают щелочными свойствами и могут реагировать с кислотами и основаниями.
Реакции щелочных металлов с кислотами и основаниями представляют собой химические превращения, результатом которых являются образование солей и выделение продуктов реакции. Эти реакции являются важными в химической промышленности и научных исследованиях.
Вопрос-ответ

Какие свойства имеют щелочные металлы?
Щелочные металлы имеют низкую плотность, низкие температуры плавления и кипения, отличную электропроводность, мягкость и реакцию с водой.
Чем отличаются щелочные металлы от других элементов?
Основное отличие щелочных металлов от других элементов - их атомы обладают одним электроном на внешней энергетической оболочке, что делает их очень реакционными и химически активными.
Как реагируют щелочные металлы с водой?
Щелочные металлы реагируют с водой, образуя гидроксиды щелочных металлов и выделяя водород.
Какие соединения образуют щелочные металлы с кислородом?
Щелочные металлы образуют оксиды, пероксиды и супероксиды. Например, натрий образует оксид Na2O, пероксид Na2O2 и супероксид NaO2.
Какие еще реакции могут совершать щелочные металлы?
Щелочные металлы также могут реагировать с кислотами, образуя соответствующие соли и выделяя водород. Кроме того, они сжигаются в атмосфере, образуя оксиды с соответствующими яркими пламенами.
