Щелочные металлы - это химические элементы, которые находятся в первой группе периодической системы. Они включают в себя литий, натрий, калий, рубидий, цезий и франций. Эти металлы очень активны, так как они имеют одну электронную оболочку, которую они легко отдают. Это делает их хорошими соединителями их применений.
Одно из основных применений щелочных металлов - это в производстве прочных и легких металлических сплавов. Натрий, калий и литий, например, могут быть добавлены в сплавы алюминия для улучшения их прочности и устойчивости к коррозии. Щелочные металлы также используются в производстве различных легированных сталей, которые используются в авиации, автомобильной и энергетической промышленности.
Щелочные металлы также находят широкое применение в производстве щелочных батарей. Эти батареи используют среду с целью генерации электрической энергии. В таких батареях, анодом является щелочной металл, которую окисляется и передает электроны в катод. Это позволяет батарее хранить и выдавать энергию в течение длительного времени. Щелочные батареи широко используются в электронике, автомобильной промышленности и многих других областях.
Соединение щелочных металлов
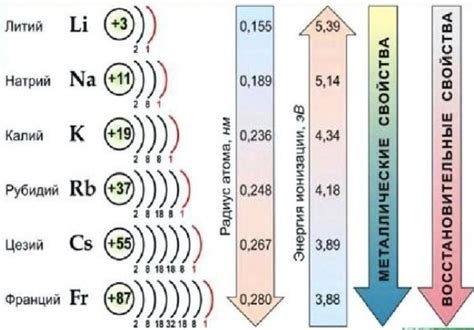
Щелочные металлы – это элементы, относящиеся к первой группе периодической таблицы. Включая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), они имеют общую оболочку электронов и похожие свойства.
Соединение щелочных металлов происходит преимущественно с галогенами (фтором, хлором, бромом, йодом) и окислителями. Щелочно-металлические соединения обладают различными свойствами и применяются в различных областях.
Оксиды щелочных металлов. Они обладают щелочными свойствами и применяются в производстве стекол, электролитических косметических средств и моющих средств. Например, оксид натрия (Na2O) используется для получения стекла, а оксид калия (K2O) – для производства электролитических щелочных батарей.
Галогениды щелочных металлов. Они представляют собой соединения щелочных металлов с галогенами и применяются в различных отраслях промышленности. Например, хлорид натрия (NaCl) – это обычная поваренная соль, а хлорид калия (KCl) используется в медицине для поддержания уровня калия в организме.
Гидриды щелочных металлов. Они образуются при соединении щелочных металлов с водородом и широко используются в качестве средств водородного транспорта и хранения. К примеру, гидрид лития (LiH) применяется в синтезе органических соединений и в производстве литиевых аккумуляторов.
Таким образом, соединение щелочных металлов имеет множество практических применений в различных областях, от производства стекла и моющих средств до синтеза органических соединений и применения в медицине.
Физические свойства

Щелочные металлы - это группа элементов периодической таблицы, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются от других металлов своими особенностями и физическими свойствами.
Первое заметное физическое свойство щелочных металлов - это их мягкость. Они настолько мягкие, что их можно резать ножом. Это связано с тем, что у атомов щелочных металлов всего один валентный электрон, что делает их структуру нестабильной. Этот электрон легко перемещается, что обуславливает мягкость металлов.
Второе физическое свойство щелочных металлов - это низкая плотность. Они являются наименее плотными металлами в периодической таблице, что делает их легкими и удобными для использования в различных приложениях.
Третье физическое свойство щелочных металлов - это их способность образовывать сплавы с другими металлами. Это делает их полезными в производстве различных металлических сплавов, таких как алюминиево-литиевые сплавы, которые обеспечивают высокую прочность и легкость.
Кроме того, щелочные металлы обладают высокой теплопроводностью и электропроводностью, что делает их полезными в различных технологических процессах и применениях. Например, они используются в производстве батарей, взрывчатых веществ, стекла и даже в ядерных реакторах.
В целом, физические свойства щелочных металлов делают их важными материалами в различных отраслях науки и техники и обуславливают их широкое применение в различных областях.
Химические свойства

Щелочные металлы, такие как литий, натрий, калий и рубидий, обладают высокой химической активностью из-за наличия одной валентной электронной оболочки. Это позволяет им легко образовывать ионные соединения с другими веществами.
Щелочные металлы реагируют с водой, образуя щелочные растворы и выделяя водород. Например, литий взаимодействует с водой, образуя гидроксид лития и выделяя водород. Это явление может быть использовано в батареях, где энергия выделяется в результате реакции между щелочными металлами и водой.
Щелочные металлы также реагируют с кислородом воздуха, образуя оксиды, например, оксид лития или оксид натрия. Эти соединения имеют важное практическое применение в области стеклопроизводства и изготовления керамики.
Другими химическими свойствами щелочных металлов являются их способность образовывать сольные соединения с кислотами, образовать сложные катионы и входить в реакции с различными неорганическими и органическими соединениями.
Кроме того, щелочные металлы обладают яркой фотоэмиссионной способностью, что позволяет применять их в технологии создания полупроводниковых приборов и солнечных батарей.
Процесс синтеза
Синтез щелочных металлов является сложным и многоступенчатым процессом, требующим использования специального оборудования и внимательного контроля. Основным источником щелочных металлов является природная руда, содержащая соли этих металлов.
Первый этап синтеза включает добычу руды и ее предварительную обработку. Руда проходит через несколько стадий: измельчение, флотация и фильтрация. Затем полученная руда подвергается химической обработке, чтобы извлечь ценные компоненты, в данном случае щелочные металлы.
Далее следует процесс обработки полученных рудных концентратов. Они загружаются в специальные печи, где происходит их плавление и обработка при высоких температурах. В результате этого процесса руда превращается в сырье с высоким содержанием щелочных металлов.
Конечный этап синтеза включает рафинирование полученного сырья. Оно проводится с использованием различных методов, таких как электролиз или химическая очистка. Цель рафинирования - удаление примесей и получение чистого щелочного металла.
Полученные щелочные металлы имеют широкое практическое применение в различных отраслях промышленности и науки. Они используются в производстве щелочных аккумуляторов, стекла, полупроводников, лекарственных препаратов и других продуктов.
Практическое применение

Щелочные металлы имеют широкое практическое применение в различных областях нашей жизни.
Натрий, калий и литий широко используются в производстве щелочных батарей. Они являются главными компонентами энергетических источников, которые применяются во многих электронных устройствах, таких как мобильные телефоны, ноутбуки и планшеты. Благодаря своей высокой энергетической плотности, щелочные батареи являются надежным и долговечным источником питания.
Кроме того, щелочные металлы используются в производстве стекла. Натрий добавляется в стеклянную массу для снижения ее температуры плавления и улучшения ее формовки. Литий используется для создания электролитических красок, которые придают стеклу различные оттенки и оттенки. Калий применяется в производстве стеклотары и стеклянных контейнеров.
Щелочные металлы также используются в медицине. Калий является важным элементом питания и используется в качестве добавки в некоторых лекарствах. Литий применяется в психоактивных препаратах для лечения биполярного расстройства и депрессии. Натрий используется в инфузионных растворах для гидратации и регулирования электролитного баланса в организме.
Кроме того, щелочные металлы используются в производстве сплавов, средств для пожаротушения, косметических и косметических средств, а также в производстве пестицидов и удобрений.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это группа химических элементов, которые находятся в первой группе периодической таблицы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой активностью и реактивностью, образуют щелочные оксиды и гидроксиды в контакте с водой.
Как соединение щелочных металлов получается?
Соединение щелочных металлов может быть получено путем реакции металла с кислотой для образования соли или с использованием других методов, таких как электролиз. Например, когда щелочный металл реагирует с водой, образуется щелочь (гидроксид металла) и выделяется водород.
Какие свойства имеют соединения щелочных металлов?
Соединения щелочных металлов обладают рядом характеристических свойств. Среди них высокая растворимость в воде, образование щелочных растворов (щелочь), амфотерность, способность образовывать соли с кислотами, способность образовывать стабильные соединения с другими элементами, низкая плотность, низкая температура плавления и кипения и т. д.
Какие практические применения имеют соединения щелочных металлов?
Соединения щелочных металлов имеют широкое применение в различных областях. Например, гидроксиды щелочных металлов используются в химической промышленности для производства мыла, стекла и многих других продуктов. Они также используются в производстве батарей, лекарств и удобрений. Щелочные металлы также широко используются в лабораторных исследованиях и различных технических процессах.
