Натрий (Na) - это щелочной металл, который находится в первой группе периодической таблицы. Он обладает различными физическими и химическими свойствами, которые делают его важным элементом для многих процессов и приложений. Натрий является очень реактивным металлом и образует широкий спектр соединений.
Благодаря своей высокой реактивности, натрий очень активно взаимодействует с водой. При контакте с водой натрий быстро реагирует, образуя гидроксид натрия (NaOH) и выделяя водород (H₂). Эта реакция является очень сильной, и при неправильном обращении с натрием она может привести к серьезным последствиям.
Одно из наиболее распространенных соединений натрия - это хлорид натрия (NaCl), или обычная кухонная соль. Хлорид натрия широко используется в пищевой промышленности, медицине, и других отраслях деятельности. Он имеет солоноватый вкус и используется как приправа к пище, консервант и вещество для поддержания электролитного баланса в организмах живых существ.
Вместе с тем натрий также может образовывать различные соединения с кислородом, такие как оксид натрия (Na₂O) и пероксид натрия (Na₂O₂). Оксид натрия часто используется в стекольной, керамической и электротехнической промышленности, а пероксид натрия применяется в процессе отбеливания и как кислородное отпаривающее средство.
Свойства натрия: что нужно знать о щелочном металле

Натрий является щелочным металлом, одним из основных элементов в периодической системе химических элементов. Он относится к группе I, что делает его крайне реактивным и химически активным веществом.
У натрия есть ряд характерных свойств. Во-первых, натрий обладает металлическим блеском и серебристо-белым цветом. Он мягкий и легко режется ножом. Кроме того, натрий хорошо проводит электричество и тепло, что делает его полезным материалом в электронной и электротехнической промышленности.
Натрий также обладает высокой реактивностью в присутствии влаги и кислорода. Он легко окисляется и может образовывать различные соединения, включая оксиды, гидроксиды и соли. Это делает натрий важным элементом в процессах химического синтеза и производстве различных химических веществ.
Физические и химические свойства натрия также приводят к его широкому применению в различных отраслях промышленности. Натрий используется в производстве мыла, стекла, щелочи, каучука, пищевых добавок, лекарственных препаратов и многих других продуктов.
Кроме того, натрий имеет большую важность в биологических системах. Он является одним из основных электролитов в организме человека и играет ключевую роль в поддержании правильной работы клеток и нервной системы. Натрий также необходим для регуляции водного баланса и кровяного давления.
Атомный номер и химические свойства

Атомный номер: Натрий - щелочной металл в периодической таблице, обозначенный символом Na и имеющий атомный номер 11. Это означает, что у натрия 11 электронов.
Реакционная способность: Натрий является очень реакционным металлом из-за своей высокой активности. Он реагирует с водой, кислородом и другими неметаллами. Реакция натрия с водой является одной из наиболее известных реакций, при которой образуется щелочь и выделяется водород.
Проводимость: Натрий обладает хорошей электропроводностью, что делает его полезным материалом для производства электрических проводов и других электронных устройств.
Реакция с воздухом: Натрий быстро реагирует с кислородом из воздуха, образуя оксид натрия (Na2O) и нитрат натрия (NaNO3). Это происходит при комнатной температуре и вызывает образование белого налета на поверхности натрия.
Реакция с водой: Натрий активно взаимодействует с водой, выделяя водород и образуя щелочь – гидроксид натрия (NaOH).
Способность к окислению: Натрий имеет один электрон во внешней электронной оболочке, что делает его стабильным окислителем, способным передавать свой электрон другим веществам.
Физические характеристики: Натрий – серебристо-белый металл, мягкий и хорошо формируемый. Он имеет низкую плотность и температуру плавления (97,8°C), что делает его подходящим для использования в различных промышленных процессах.
Использование: Натрий широко используется в различных областях, включая производство шлака, стекла, щелочи, синтеза органических соединений и процессов очистки воды. Он также находит применение в производстве алюминия, тональных пигментов и водородных технологий.
Физические свойства натрия и его реакции

Натрий - щелочной металл, химический элемент с атомным номером 11 и символом Na в периодической системе элементов. За свою историю он был широко использован в различных областях науки и промышленности.
Натрий обладает ярко-желтой окраской и мягкой, пластичной консистенцией. Он имеет низкую плотность и плавится при относительно низкой температуре около 97,8 градусов Цельсия. При комнатной температуре натрий реактивен и быстро окисляется на воздухе.
Реакция натрия с водой очень яркая и впечатляющая. При контакте с водой натрий шипит, искры летят во все стороны, образуется гидроксид натрия (щелоча) и выделяется водород. Эта реакция является очень быстрой и экзотермической, то есть сопровождается выделением значительного количества тепла и света. В результате реакции образуется прозрачный раствор щелочи, который можно использовать в различных промышленных процессах.
Кроме того, натрий может реагировать с различными другими элементами и соединениями. Например, он реагирует с кислородом, образуя оксид натрия (щелочная зола) и выделяя большое количество тепла. Также натрий может реагировать с многими кислотами, образуя соответствующие натриевые соли.
В заключении, физические свойства натрия, такие как его металлический блеск, мягкость и реактивность, делают его универсальным и востребованным элементом в научных и промышленных исследованиях. Его способность к ярким реакциям и выделению тепла позволяет использовать его в различных химических процессах и производствах.
Важность соединения щелочного металла натрия
Соединение щелочного металла натрия, также известное как натрий, играет важную роль в различных сферах жизни. Натрий является одним из наиболее распространенных элементов на Земле и входит в состав многих соединений.
1. Промышленное значение. Натрий часто используется в промышленности для производства различных материалов. Например, натрий используется для производства стекла, керамики и мыла. Также натрий применяется в производстве широкого спектра химических соединений, включая пластичные полимеры и фармацевтические препараты.
2. Роль в пищевой промышленности. Натрий является важным элементом пищевой промышленности. Он используется в качестве добавки для улучшения вкуса и сохранности пищевых продуктов. Один из наиболее известных компонентов, содержащих натрий, - это поваренная соль, без которой невозможно представить большинство блюд.
3. Регулятор водного баланса. Натрий играет важную роль в поддержании нормального водного баланса в организме. Он отвечает за уровень гидратации клеток, плазмы крови и регулирует кровяное давление. Недостаток натрия может привести к дегидратации, снижению мускульного тонуса и другим проблемам.
4. Получение энергии. Натрий также играет важную роль в процессе получения энергии в организмах. Он участвует в передаче нервных импульсов и сокращении мышц. Кроме того, натрий входит в состав многих энзимов, необходимых для обмена веществ.
- Вывод:
Соединение щелочного металла натрия имеет широкое применение в различных сферах жизни. Оно используется в промышленности для производства разных материалов, в пищевой промышленности как добавка, а также играет важную роль в организме, регулируя водный баланс и обеспечивая получение энергии. В свете этого, натрий можно считать одним из самых важных химических элементов для человечества.
Вопрос-ответ

Какие свойства имеет натрий?
Натрий - щелочной металл, обладающий рядом характерных свойств. Он мягкий, имеет серебристо-белый цвет, реагирует с водой, взрывается в контакте с кислородом, образует соль с хлором и другими сильными кислотами. Натрий является активным элементом, который широко используется в промышленности и науке.
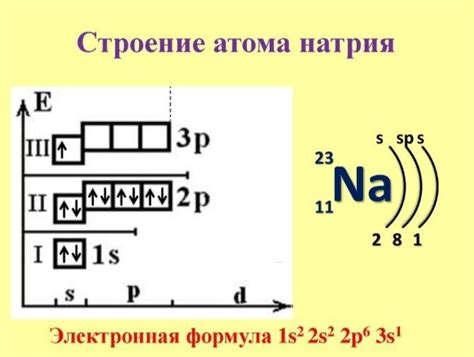
Каково строение атома натрия?
Атом натрия состоит из ядра, в котором находятся протоны и нейтроны, а вокруг ядра вращаются электроны. У натрия есть 11 электронов, распределенных на различные энергетические уровни. На внешнем энергетическом уровне находится один электрон, что делает натрий активным и готовым реагировать с другими веществами.
Каким образом натрий реагирует с водой?
Натрий реагирует с водой очень активно. При контакте с водой он реагирует с молекулами воды, образуя щелочь и выделяя водород. Реакция протекает очень быстро, с выделением тепла и образованием пламени. Поэтому натрий должен храниться в хладной и сухой среде, чтобы избежать нежелательных реакций.
Какие соединения образуются при взаимодействии натрия с кислородом?
Натрий очень реактивен с кислородом и образует оксид натрия (Na2O) или пероксид натрия (Na2O2), в зависимости от условий реакции. Оксид натрия имеет более высокую температуру плавления и используется в производстве стекла, керамики и мыла. Пероксид натрия применяется в качестве кислорода в самолетах и спасательных масках.
