Со4 или Со4 (сульфат кобальта) – необычное соединение, которое вызывает споры и неоднозначные мнения среди ученых и специалистов. Одни считают, что Со4 – это металл, другие утверждают, что оно является не металлом, а ионным соединением. Понять и разобраться в этой дискуссии позволяет обширное исследование и анализ свойств и структуры Со4.
Некоторые аргументы приводятся в пользу того, что Со4 является металлом. Во-первых, строение соединения образовано атомами металла кобальта (Co) и атомами кислорода (O). Кроме того, Со4 обладает типичными для металлов свойствами, такими как теплопроводность и электропроводность. Также металлическое поведение Со4 проявляется в его способности образовывать сплавы с другими металлами.
Однако есть и аргументы, свидетельствующие против принадлежности Со4 к металлам. Во-первых, наличие ионов у данного соединения, отсутствующих у металлов. Во-вторых, характерное для ионных соединений образование кристаллической структуры Со4. Более того, Со4 обычно растворяется в воде, а растворы соединений металлов по определению не имеют способности к растворению.
Таким образом, вопрос о том, является ли Со4 металлом или нет, остается открытым и требует дальнейших исследований и обсуждений. Со временем, по мере развития науки и накопления новых данных, можно будет получить более точный ответ на этот вопрос.
Определение So4
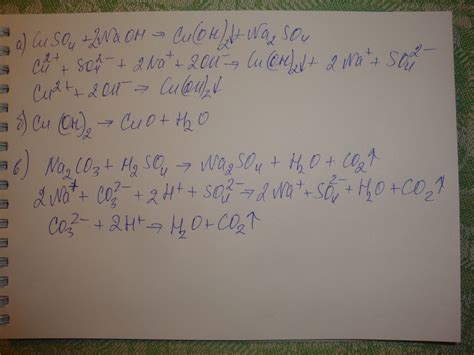
So4 - это химическая формула сульфата, который является соединением серы и кислорода. Сульфаты широко распространены в природе и могут быть найдены в различных минералах, водах и почвах. Они также являются важными компонентами в различных промышленных процессах, в том числе в производстве удобрений и химических продуктов.
Сульфаты обладают химическими и физическими свойствами, которые делают их уникальными соединениями. Они обычно образуют кристаллические структуры и хорошо растворяются в воде. Некоторые сульфаты могут образовывать двойные соли с другими соединениями, что придает им дополнительные свойства и применения. Сульфаты также могут проявлять кислотные или щелочные свойства в зависимости от соединений, с которыми они взаимодействуют.
В химической классификации сульфаты относятся к группе солей. Они могут быть образованы реакцией серы или серной кислоты с основаниями или металлами. Многие сульфаты содержат металлы, такие как кальций, натрий, магний и медь. Однако, не все сульфаты содержат металлы, и некоторые из них могут быть классифицированы как неорганические кислоты, такие как серная кислота. Определение So4 зависит от химической и физической природы соединения, включая его структуру, состав и свойства.
Таким образом, So4 можно классифицировать как соединение, образующее соли с металлами и обладающее химическими и физическими свойствами сульфатов. Определение So4 включает широкий спектр соединений, которые имеют большое значение в науке, промышленности и повседневной жизни.
Физические свойства So4

Форма: So4 представляет собой белый кристаллический порошок или кристаллы в виде тонких иголок.
Температура плавления: Температура плавления So4 составляет около 600°C.
Твердость: So4 имеет достаточно высокую твердость на микроскопическом уровне.
Растворимость: So4 хорошо растворяется в воде, образуя гидратированный соединитель, а также растворяется в некоторых органических растворителях.
Другие физические свойства: So4 обладает отличными электрофизическими свойствами, так как его кристаллическая структура образует ионные решетки. Он также обладает низкой теплопроводностью и является изолятором.
Устойчивость: So4 стабилен при обычных условиях, но может подвергаться реакциям сильных окислителей или образовывать более сложные соединения с другими элементами.
Химические свойства So4

So4, или сульфат, является одним из самых распространенных соединений серы. Он образуется при соединении серы с кислородом. Сульфаты имеют широкое применение в различных отраслях, таких как медицина, производство пищевых продуктов и промышленность.
Физические свойства: So4 представляет собой кристаллическую соль, часто белого цвета, нерастворимую в органических растворителях. Они обычно образуют кристаллическую решетку и могут образовывать гидраты, то есть соединения с молекулярной водой. Сульфаты обычно имеют высокую температуру плавления и весьма стабильны при обычных условиях.
Химические свойства: So4 обладает кислотными свойствами и может образовывать соли, растворимые в воде. Это связано с тем, что гидроксиды металлов образуют сульфаты, когда реагируют с серной кислотой. Один из наиболее известных сульфатов - медный сульфат (CuSO4), который используется в сельском хозяйстве и в качестве катализатора в химической промышленности.
So4 также может образовывать двойные соли с другими соединениями. Например, магниевый сульфат (MgSO4) может образовывать двойную соль с гексагидратом и называться эпсомской солью. Эта соль широко используется в медицинских процедурах, а также в косметике и сельском хозяйстве.
Некоторые сульфаты имеют токсичные свойства и могут быть опасны для здоровья человека и окружающей среды. Поэтому важно обращаться с ними аккуратно и соблюдать меры предосторожности при работе с ними.
Применение So4
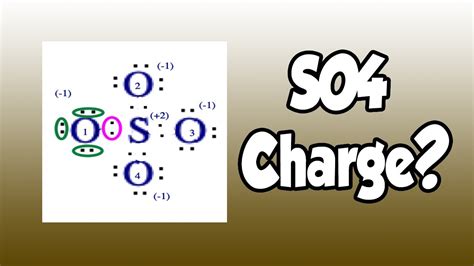
Сульфат (So4) — это химическое соединение, которое может быть использовано в различных областях. Этот ион имеет много полезных свойств, что делает его востребованным и ценным.
Применение So4:
- Промышленность: So4 широко используется в промышленности для получения различных химических соединений и продуктов. Например, сульфаты металлов, такие как медь и цинк, используются в электроплантации и гальванотехнике.
- Сельское хозяйство: Сульфаты, содержащие So4, используются в качестве удобрений для почвы. Эти удобрения обогащают почву необходимыми макро- и микроэлементами, способствуют росту и развитию растений.
- Фармацевтика: В некоторых лекарственных препаратах So4 используется как активный компонент. Например, сульфат магния используется в качестве основного компонента для производства магнезии и лаксативных препаратов.
- Водоочистка: Сульфат используется в процессе химической очистки воды. Он помогает удалить загрязнения и осаждать тяжелые металлы, что обеспечивает чистоту питьевой воды.
- Производство бумаги: So4 применяется в процессе производства бумаги, так как может улучшить вязкость и степень связывания волокон в целлюлозной массе, что позволяет получить более качественную и прочную бумагу.
Это лишь некоторые примеры использования So4. Этот ион играет важную роль в различных отраслях и имеет широкий спектр применений.
Роль So4 в экологии

So4 (сульфат) является значимым компонентом окружающей среды и играет важную роль в экологических процессах. Он является основным ионом в растворах, образующихся при окислении сероводорода в водной среде.
So4 является неотъемлемым элементом питания для многих видов растений и микроорганизмов. Он участвует в образовании аминокислот, белков и ферментов, необходимых для жизнедеятельности организмов. Кроме того, So4 является важным источником серы для растений, которая является необходимой для их роста и развития.
Однако, неконтролируемое присутствие больших концентраций So4 может быть вредным для экосистем. Высокие уровни So4 в почве или воде могут вызывать несбалансировку питательных веществ для растений, что может привести к их ослаблению и смерти. Кроме того, So4 может также вызывать изменение pH-значения почвы, что негативно сказывается на микроорганизмах и других организмах, находящихся в данной экосистеме.
Поэтому, контролирование уровня So4 в окружающей среде является важной задачей. Необходимо разрабатывать и применять методы очистки воды и почвы от избыточного So4, а также принимать меры по предотвращению загрязнения окружающей среды этим веществом, например, устанавливая специальные фильтры на предприятиях, выделяющих большие объемы So4 в окружающую среду.
Вопрос-ответ

Может ли So4 быть металлом?
Нет, So4 (сульфат) не может быть металлом. So4 - это ион, который может соединяться с металлами, но сам по себе не является металлом.
Какое значение имеет So4 в химии?
So4 (сульфат) имеет большое значение в химии. Он является одним из самых распространенных химических соединений и широко используется в различных отраслях, включая производство удобрений, производство химических реагентов, а также в медицине и пищевой промышленности.
