В химии существует огромное количество элементов, которые можно разделить на две главные группы: металлы и неметаллы.
Однако есть некоторые вещества, которые вызывают сомнения в отношении своей классификации. Одним из таких веществ является So4.
So4 - это химическая формула сульфата, одного из важных химических соединений. Сульфаты встречаются в природе и широко используются в промышленности.
С точки зрения классификации So4 можно отнести и к металлам, и к неметаллам. С одной стороны, это вещество содержит серу, которая обычно относится к неметаллам. С другой стороны, некоторые из соединений So4 содержат металлические ионы, такие как натрий, калий или магний.
Таким образом, можно сделать вывод, что So4 неявно показывает нам, что в химии между металлами и неметаллами нет строгой границы, и некоторые вещества могут обладать чертами обоих классов.
Свойства So4

So4 (сернистая кислота) является кислотой сильного характера и растворяется в воде, образуя серные кислотные растворы. Однако, So4 обладает некоторыми особенностями, отличающими его от других кислот.
Состояние: So4 представляет собой бесцветную кристаллическую субстанцию, которая может принимать вид порошка или гранул. Он обладает хорошей растворимостью в воде, при этом образуя полностью прозрачные растворы.
Кислотные свойства: So4 относится к сильным кислотам и легко реагирует с основаниями. Он образует соли - сульфаты, которые широко используются в различных отраслях промышленности.
Окислительные свойства: So4 обладает окислительными свойствами, что означает его способность окислять другие вещества в процессе химических реакций. В то же время, So4 сам может быть окислен в ряде соответствующих реакций.
Применение: В основном So4 находит применение в промышленности для производства кислотных растворов, а также в процессе синтеза различных соединений. Кроме того, So4 используется в производстве удобрений, где является источником серы.
Что такое So4?

So4 - это химическая формула, обозначающая сульфат. Сульфаты являются солями, которые образуются при образовании соединения серной кислоты (H2SO4) с металлами или основаниями.
Сульфаты могут быть как металлическими, так и неметаллическими соединениями, в зависимости от металла или неметалла, с которым они образуются. Например, сульфат железа (FeSO4) является металлическим соединением, тогда как сульфат аммония (NH4)2SO4) является неметаллическим соединением.
Сульфаты широко распространены в природе и составляют существенную часть земной коры. Они также находятся в водах, почве и растениях. Благодаря своей химической стабильности, сульфаты часто используются в промышленности, сельском хозяйстве, медицине и других сферах.
Сульфаты имеют различные свойства и применения. Например, сульфат магния (MgSO4), также известный как эпсомская соль, часто применяется в медицине для облегчения мышечных болей и снятия воспаления. Сульфат цинка (ZnSO4) используется в качестве удобрения и добавки в пищу, а сульфат меди (CuSO4) применяется в процессе гальванизации и возделывания почвы.
Таким образом, сульфаты представляют собой важные химические соединения, которые находят широкое применение в различных отраслях промышленности и научных исследованиях.
Физические свойства So4

So4 - химическое соединение, известное также как сернистый кислород. Оно представляет собой белый кристаллический порошок, который обладает специфическим запахом и вкусом.
Точка плавления So4 составляет около 110 градусов Цельсия. При нагревании оно переходит в жидкое состояние и может легко испариться, образуя газообразные соединения.
So4 плохо растворимо в воде, его растворы обладают кислотными свойствами. Однако So4 легко растворяется в многих органических растворителях, таких как этанол и эфир.
So4 имеет высокую плотность - около 2,28 г/см3. Это делает его тяжелым веществом и дает ему повышенную устойчивость к давлению.
So4 является одним из основных компонентов смога и промышленных выбросов. Он может образовываться при сгорании топлива, содержащего серу. В атмосферных условиях So4 образует раствор в воздухе, называемый серным аэрозолем.
Таким образом, физические свойства So4 обуславливают его химическое поведение и активное участие в различных процессах, связанных с окружающей средой и промышленностью.
Химические свойства So4

So4 (сульфат) - химическое соединение, образующееся при сочетании серы и кислорода. Сульфаты широко распространены в природе и имеют разнообразные химические свойства.
Сульфаты могут быть растворимыми или нерастворимыми в воде. Некоторые из наиболее известных растворимых сульфатов включают MgSO4 (сульфат магния) и Na2SO4 (сульфат натрия). Растворимость сульфатов зависит от различных факторов, включая температуру, концентрацию и растворитель.
Сульфаты обладают характерным запахом и могут образовывать кристаллы при определенных условиях. Они также могут обладать слабокислыми свойствами, что часто проявляется в их взаимодействии с основаниями.
Сульфаты могут выступать как окислители или восстановители в реакциях. Некоторые сульфаты, например FeSO4 (сульфат железа), могут быть использованы в качестве катализаторов для различных химических реакций.
Сульфаты также широко используются в промышленности. Например, алюминиевые сульфаты используются в производстве бумаги, а калийные сульфаты - в сельском хозяйстве как удобрения.
В целом, химические свойства So4 делают его важным соединением во многих процессах и применениях, от промышленности до нашего ежедневного быта.
Применение So4
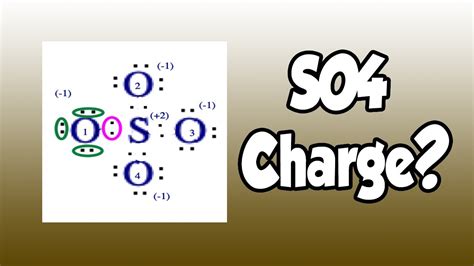
So4, или сульфат, является химическим соединением, состоящим из серы и кислорода. Этот соединение имеет широкое применение в различных областях:
- Производство удобрений: Сульфат используется в качестве сырья для производства различных видов удобрений, таких как аммонийный сульфат. Удобрения на основе сульфата предоставляют растениям необходимый для роста и развития источник серы.
- Производство бумаги: Сульфат кальция, получаемый из сульфата, используется в процессе производства бумаги. Он добавляется в целлюлозу для улучшения свойств бумаги, таких как прочность и водостойкость.
- Производство кожи: Сульфат алюминия, получаемый из сульфата, применяется в производстве кожи. Он используется для обработки кожи, чтобы придать ей устойчивость к влаге, прочность и эластичность.
- Производство красителей: Сульфаты различных металлов используются в производстве красителей. Они добавляются в красители для улучшения их стойкости к свету и повышения интенсивности цвета.
- Очистка воды: Сульфат алюминия используется в процессе очистки воды от загрязнений. Он образует осадок, который может улавливать и удалять различные вещества, такие как тяжелые металлы и органические загрязнители.
Таким образом, So4 имеет широкое применение в различных отраслях, начиная от сельского хозяйства и заканчивая промышленным производством. Его свойства и возможности применения делают его важным компонентом во многих процессах, способствуя повышению эффективности и качества различных продуктов и материалов.
Где используют So4?

So4, или сульфат, широко используется в различных отраслях промышленности и научных исследованиях.
Химическая промышленность: So4 используется в качестве основного компонента при производстве серной кислоты. Она является одной из самых важных химических веществ, используемых в производстве множества продуктов, от удобрений до косметики.
Медицина: So4 применяется в лекарственной промышленности для получения некоторых лекарственных препаратов, включая группу препаратов, обладающих противовоспалительным и противоаллергическим действием.
Удобрения: So4 используется в качестве удобрения для почвы. Сульфат содержит важный для растений элемент - серу, который необходим для их роста и развития. Это позволяет повысить урожайность и качество сельскохозяйственных культур.
Гальваническая промышленность: So4 используется в гальванической промышленности для создания электролитических растворов для электрохимических процессов, таких как электролиз и гальваническое покрытие.
Научные исследования: So4 широко используется в лабораторных условиях для проведения различных химических реакций и анализа образцов. Он может быть использован в качестве компонента в различных химических средах для достижения определенных результатов.
Производство бумаги: В процессе производства бумаги, So4 применяется для обработки древесной массы, что помогает удалить остатки органических веществ и придает бумаге необходимую прочность и водостойкость.
Пищевая промышленность: So4 может быть использован в пищевой промышленности в качестве добавки, улучшающей вкус и консистенцию продуктов, таких как сыры, мороженое и газированные напитки.
В целом, So4 - это важное химическое соединение, используемое в большом количестве отраслей и функциональных областей, обеспечивая им эффективное функционирование и развитие.
Итоги и выводы

Определение, является ли So4 металлом или неметаллом, может быть сложной задачей, так как он обладает свойствами обоих классов элементов.
Первое, что следует отметить, это то, что So4 представляет собой химическую формулу сульфата, которая может включать в себя различные ионы, включая ионы металлов, такие как натрий, калий и магний.
В то же время, So4 также может быть одним из главных компонентов кислот, таких как серная кислота, что указывает на его неметаллическую природу.
Таким образом, можно сказать, что So4 обладает свойствами и металлов, и неметаллов, в зависимости от ситуации и контекста его использования.
Однако, при исследовании реакций So4 с другими химическими элементами и соединениями, можно прийти к более конкретным заключениям о его химической природе.
Несмотря на то, что So4 может обладать свойствами и металлов, и неметаллов, его поведение и реакции обычно ближе к неметаллам, особенно в сильно кислых условиях или при взаимодействии с другими неметаллическими элементами.
Итак, вопрос о природе So4 может быть открытым и требует дальнейших исследований и экспериментов для полного и точного понимания его свойств.
Вопрос-ответ

Какие свойства характерны для металлов?
Металлы обладают высокой тепло- и электропроводностью, металлическим блеском, гибкостью и пластичностью. Также они обычно образуют ионы с положительным зарядом.
Чем отличаются металлы от неметаллов?
Металлы обычно обладают хорошей тепло- и электропроводностью, блестят, имеют высокую пластичность и образуют положительно заряженные ионы. Неметаллы, в свою очередь, плохо проводят тепло и электричество, не блестят и обычно образуют отрицательно заряженные ионы.
Какие элементы могут относиться к неметаллам?
Неметаллами являются элементы из группы 14 (углерод, кремний), 15 (азот, фосфор), 16 (кислород, сера) и 17 (хлор, фтор).
А как насчет SO4 - металл или неметалл?
SO4 является анионом - отрицательно заряженной частицей. Поэтому он относится к неметаллам.
