Электрохимическая коррозия – это процесс разрушения металлов под воздействием окружающей среды, вызванного электрохимическими реакциями. Она является одной из основных причин повреждения металлических конструкций и сооружений, и имеет серьезные последствия для безопасности и экономики. Электрохимическая коррозия особенно опасна при контакте различных металлов, так как это может ускорить процесс разрушения и привести к непредсказуемым последствиям.
Взаимодействие металлов в контакте может вызвать различные электрохимические реакции, такие как гальваническая коррозия. При этом, один из металлов выступает в роли анода, который окисляется, а другой – в роли катода, который восстанавливается. В результате, анодный металл подвергается интенсивной коррозии, что приводит к его разрушению. Этот процесс обусловлен разностью потенциалов между металлами и наличием электролита, который является проводником для электронов и ионов.
Определение электрического потенциала металлов играет важную роль в предотвращении электрохимической коррозии. Если два металла имеют близкие значения электрического потенциала, то контакт между ними будет менее опасным. Однако, при больших различиях потенциалов, особенно при наличии электролита, процесс гальванической коррозии может происходить с высокой скоростью. Поэтому, при выборе материалов для сооружений и оборудования необходимо учитывать их потенциал и возможность контакта с другими металлами.
Электрохимическая коррозия: ведущая причина разрушения металлов

Электрохимическая коррозия является одной из основных причин разрушения металлов. Она возникает при взаимодействии металлических материалов с окружающей средой, особенно в наличии влаги.
Процесс электрохимической коррозии заключается в переносе электронов между различными частями металла, что приводит к образованию электрических потенциалов и необходимости компенсации заряда. Такой перенос электронов может приводить к образованию окисленных и восстановленных областей в структуре металла.
Электрохимическая коррозия может приводить к образованию гальванических элементов, где разные части металла выступают в роли анода и катода. При наличии электролита и потенциальной разности происходит передача электрического тока, что приводит к ускоренной коррозии.
Существует несколько факторов, которые влияют на развитие электрохимической коррозии. Это включает в себя химический состав окружающей среды, содержание кислорода и воды, температуру, наличие загрязнений и так далее. Для предотвращения коррозии необходимо применять защитные покрытия, контролировать условия эксплуатации и выбирать подходящие материалы для конкретного приложения.
Механизм взаимодействия металлов с окружающей средой

Механизм взаимодействия металлов с окружающей средой может быть различным и зависит от условий, в которых происходит контакт металла с другими веществами. Особенно часто такое взаимодействие наблюдается при попадании влаги или кислоты на поверхность металла.
Одним из основных механизмов взаимодействия металлов с окружающей средой является электрохимическая коррозия. При этом происходит окисление и выделение электронов с поверхности металла, что вызывает электролитические реакции и разрушение материала. Электрохимическая коррозия может приводить к значительным повреждениям конструкций и оборудования.
Другим механизмом взаимодействия металлов с окружающей средой является химическое взаимодействие. В этом случае происходит химическая реакция между металлом и воздухом, водой или другими веществами. Такие реакции могут приводить к образованию оксидов, солей или других соединений, которые могут вызывать коррозию металла.
Для защиты металлов от взаимодействия с окружающей средой используют различные методы, включая нанесение защитных покрытий, использование антикоррозионных добавок и проведение регулярной проверки и обслуживания оборудования. Понимание механизма взаимодействия металлов с окружающей средой позволяет разработать эффективные методы предотвращения и борьбы с коррозией.
Основные факторы, влияющие на скорость коррозии
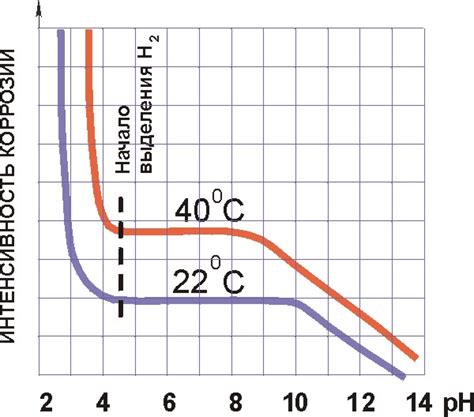
1. Электрическая разность потенциалов. Коррозия возникает, когда разные металлы соприкасаются в присутствии электролита. При этом металлы образуют гальваническую пару, где один металл выступает в качестве анода, а другой – в качестве катода. Электрическая разность потенциалов между анодом и катодом является основным фактором, влияющим на скорость коррозии.
2. Химическая активность металла. Химические свойства металлов существенно влияют на их способность к коррозии. Некоторые металлы, такие как алюминий и цинк, обладают высокой химической активностью и очень быстро реагируют с воздухом и влагой, что приводит к быстрому образованию коррозионных продуктов.
3. Содержание кислорода. Кислород является одним из основных компонентов атмосферного воздуха и играет важную роль в процессе коррозии. Высокое содержание кислорода способствует активному окислению металлов, что приводит к ускоренной коррозии.
4. Влажность окружающей среды. Влажность является важным фактором, влияющим на скорость коррозии. Высокая влажность способствует образованию электролита на поверхности металла, что ускоряет процесс коррозии. Также высокая влажность способствует ускоренному росту коррозионных пленок на металлической поверхности.
5. Температура окружающей среды. Температура окружающей среды оказывает значительное влияние на скорость коррозии. При повышении температуры происходит ускорение реакций окисления металла и рост коррозионных пленок.
6. Кислотность или щелочность электролита. Кислотность или щелочность электролита также влияют на скорость коррозии. Высокая кислотность или щелочность электролита могут ускорить процесс растворения металла и образования коррозионных продуктов.
Предотвращение и защита от электрохимической коррозии
Электрохимическая коррозия является серьезной проблемой, которая может привести к разрушению металлических конструкций и оборудования. Однако существуют эффективные методы предотвращения и защиты от коррозии.
В первую очередь, важно правильно выбрать материалы для конструкции. Некоторые металлы более устойчивы к коррозии, чем другие. Например, нержавеющая сталь обладает высокой устойчивостью к коррозии и широко используется в различных отраслях промышленности.
Помимо правильного выбора материалов, следует использовать защитные покрытия и покрывающие пленки, которые создадут барьер между металлом и окружающей средой. Это могут быть покрытия на основе эпоксидной смолы или полиуретана, которые обеспечивают высокую стойкость к коррозии.
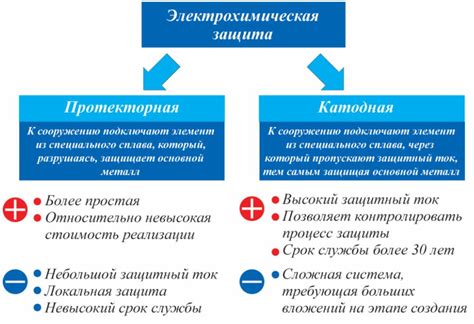
Другим эффективным методом предотвращения коррозии является катодная защита. При этом на стальной поверхности создается заряд источника постоянного тока, который подавляет реакции окисления и снижает скорость коррозии.
Немаловажным фактором для защиты от коррозии является правильное проектирование конструкций с учетом особенностей окружающей среды. Например, если стальные конструкции будут подвергаться воздействию солевого раствора или влажности, необходимо предусмотреть дополнительные меры защиты, например, использование специальных покрытий или катодной защиты.
В заключение, предотвращение и защита от электрохимической коррозии требуют комплексного подхода, который включает правильный выбор материалов, использование защитных покрытий, применение катодной защиты и учет особенностей окружающей среды при проектировании конструкций.
Вопрос-ответ

Что такое электрохимическая коррозия?
Электрохимическая коррозия - это процесс разрушения металла под влиянием химических реакций, которые происходят в контакте с электролитом (например, водой или кислотой), при наличии электрического тока.
Почему электрохимическая коррозия является опасным явлением?
Электрохимическая коррозия опасна, так как она может привести к серьезным повреждениям и даже разрушению металлических конструкций и оборудования. Кроме того, коррозия может приводить к ухудшению работоспособности и снижению срока службы металлических изделий.
Каким образом происходит электрохимическая коррозия?
Электрохимическая коррозия происходит из-за разности потенциалов между разными металлическими материалами, находящимися в контакте. В результате этого в контакте образуются аноды и катоды, где происходят окислительно-восстановительные реакции, приводящие к разрушению металла.
