Химическая реакция – это процесс превращения и преобразования веществ под воздействием различных факторов. Одним из таких факторов является расположение металлов в химической реакции. Расположение металлов в таблице активности металлов определяет их реакционную способность и скорость химических реакций, в которых они участвуют.
Металлы различаются по своей активности — способности вступать в химические реакции. Активные металлы, такие как натрий, калий, магний, реагируют с водой или кислотами, выделяя газы и вызывая интенсивные процессы. Однако реактивность металлов зависит не только от их самих, но и от условий окружающей среды.
Электронная структура металлов играет важную роль в их активности. Чем больше металл имеет свободных электронов в своей валентной оболочке, тем больше он активен. В химических реакциях активный металл отдаст электроны, а металл с меньшей активностью будет их принимать. Таким образом, расположение металлов в таблице активности определяет порядок действия реакций.
Посадочные условия металлов и их влияние на скорость химической реакции
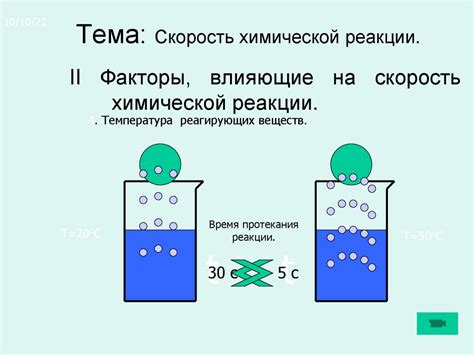
В химии существуют реакции, в которых атомы или ионы разных металлов участвуют в химическом взаимодействии. Важным фактором, влияющим на скорость химической реакции, является способ, которым металлы располагаются в реакционной среде. Расположение металлов может значительно влиять на скорость протекания химической реакции.
Одним из факторов, определяющих порядок расположения металлов, является их электрорядность. Металлы с более низкой электрорядностью имеют тенденцию распадаться на положительно заряженные ионы, отдавая электроны. Металлы с более высокой электрорядностью, наоборот, имеют тенденцию восстанавливаться, захватывая электроны. Из этого следует, что металлы с низкой электрорядностью будут более легко вступать в химические реакции и, соответственно, скорость этих реакций будет выше.
Кроме того, влияние расположения металлов на скорость химической реакции может быть связано с возможностью возникновения гальванической пары. Гальваническая пара возникает, когда в реакции участвуют два различных металла, а их поверхности имеют разную электрорядность. При наличии электролита между этими металлами возникает разность потенциалов, и начинается электрохимический процесс. В результате этого процесса скорость химической реакции увеличивается.
Таким образом, расположение металлов в реакционной среде играет значительную роль в процессе химических реакций. Электрорядность металлов, возможность образования гальванической пары и другие факторы определяют скорость протекания этих реакций. Исследование этих взаимосвязей позволяет углубить наши знания о химических процессах и использовать их в различных областях науки и техники.
Расположение металла на скорость химической реакции
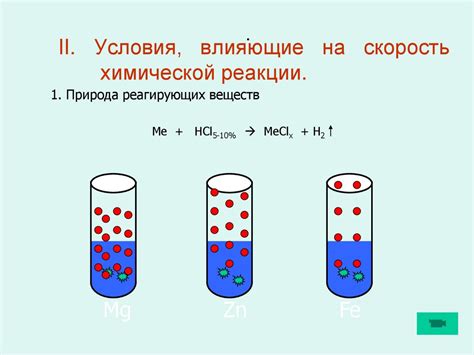
Скорость химической реакции может зависеть от расположения металла в ряду активности. Ряд активности – это упорядоченный список металлов, в котором они расположены по возрастанию их активности без рассмотрения электролита и концентрации ионов.
Чем выше металл находится в ряду активности, тем большую скорость химической реакции он обладает. Наиболее активные металлы, такие как натрий и калий, быстро реагируют с водой и выделяют водородный газ.
Это связано с их способностью легко отдавать электроны и образовывать катионы, что обусловливает высокую скорость реакции. Способность металлов к окислению связана с их электрохимическим потенциалом, который тесно связан с их расположением в ряду активности.
Металлы, расположенные внизу ряда активности, такие как золото и платина, обладают низкой активностью и малой способностью реагировать с другими веществами. Они часто применяются для изготовления украшений и различных инструментов, так как не окисляются на воздухе.
Таким образом, расположение металла в ряду активности является одним из факторов, которые определяют скорость химической реакции. Более активный металл будет реагировать быстрее и обладать высокой скоростью реакции, в то время как менее активный металл будет реагировать медленнее.
Важность каскадного расположения металлов в химических процессах

Расположение металлов в химических процессах играет важную роль и может существенно влиять на скорость реакций. Особенно значимым является каскадное расположение металлов, где они располагаются в определенной последовательности по реакционной цепочке.
Каскадное расположение металлов позволяет оптимизировать процессы прихода и ухода электронов, что ведет к ускорению химической реакции. В реакциях, основанных на передаче электронов, металлы могут действовать в качестве катализаторов, ускоряя протекание процесса.
Важно отметить, что эффективность каскадного расположения металлов в химических процессах зависит не только от их положения в реакционной цепочке, но и от их электрохимических свойств. Металлы с различными степенями окисления имеют различные возможности принимать или отдавать электроны, что влияет на скорость реакции и ее направление.
Также, при каскадном расположении металлов, можно обратить внимание на области, где изменение положения металла приводит к изменению скорости реакции. Это может быть полезно для оптимизации химических процессов, особенно в промышленности, где быстрые и эффективные реакции играют ключевую роль в производстве товаров и материалов.
Оптимизация расположения металлов для повышения скорости реакции
Изучение влияния расположения металлов на скорость химической реакции является актуальной задачей современной науки. Реакции, в которых участвуют металлы, имеют широкое применение в различных сферах, таких как катализ процессов, электрохимия, производство материалов и другие. Оптимизация расположения металлов в реакционной смеси может значительно повысить скорость химической реакции и, следовательно, улучшить эффективность процесса.
Для оптимизации расположения металлов можно воспользоваться различными методами и подходами. Одним из них является выбор оптимального сочетания металлов, учитывая их свойства и взаимодействия друг с другом. Например, металлы с разными электрохимическими потенциалами могут взаимодействовать между собой и ускорять химическую реакцию.
Другим подходом является оптимизация порядка добавления металлов в реакционную смесь. Определенный порядок добавления металлов может приводить к образованию комплексных соединений, что способствует увеличению скорости реакции.
Кроме того, использование катализаторов может быть полезным при оптимизации расположения металлов. Катализаторы активируют химический процесс и ускоряют его, тем самым повышая скорость реакции.
Важно отметить, что оптимизация расположения металлов для повышения скорости реакции требует проведения экспериментальных исследований. Использование различных методов и подходов позволяет достичь оптимального расположения металлов и повысить эффективность химического процесса.
Вопрос-ответ

Какое влияние имеет расположение металлов на скорость химической реакции?
Расположение металлов может оказывать значительное влияние на скорость химической реакции. Например, если металл находится в более активной части ряда напряжений, то он будет способствовать более быстрой реакции. Это связано с тем, что металл может донорировать электроны реагентам и таким образом ускорить процесс.
Какие факторы влияют на скорость химической реакции при разном расположении металлов?
При разном расположении металлов, факторы, такие как энергия активации реакции, наличие катализаторов и поверхность реагентов, будут иметь различное влияние на скорость химической реакции. Например, если металл находится в более активной части ряда напряжений, то энергия активации будет меньше, что приведет к более быстрой реакции.
Какие результаты исследования показывают влияние расположения металлов на скорость химической реакции?
Исследования показывают, что при разном расположении металлов в ряду напряжений, скорость химической реакции может значительно различаться. Например, когда металл находится в более активной части ряда напряжений, реакция может протекать более быстро, благодаря его способности донорировать электроны реагентам.
Каким образом можно объяснить влияние расположения металлов на скорость химической реакции?
Влияние расположения металлов на скорость химической реакции может быть объяснено электрохимическими процессами. Причиной такого влияния является способность металлов донорировать электроны реагентам. Когда металл находится в более активной части ряда напряжений, он более эффективно передает электроны, что ускоряет реакцию.
