Щелочные металлы - это элементы, которые расположены в первой группе периодической системы химических элементов. Все они являются крайне активными и химически реакционными веществами. Одним из основных химических свойств щелочных металлов является наличие одного электрона на внешнем энергетическом слое.
Периодическая система химических элементов состоит из семи горизонтальных строк, называемых периодами, и 18 вертикальных столбцов, называемых группами. Щелочные металлы состоят из элементов: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они все находятся в первой группе периодической системы и имеют одинаковое количество электронов на внешнем энергетическом слое.
Внешний энергетический слой, который находится на самом большом расстоянии от ядра атома, называется валентным энергетическим слоем. В случае с щелочными металлами, валентный энергетический слой содержит один электрон. Именно этот электрон отвечает за химические свойства щелочных металлов и их активность в химических реакциях.
Краткий обзор

Щелочные металлы представляют собой группу элементов, которые находятся в первой группе периодической таблицы. К этой группе относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются наиболее реактивными металлами и имеют свойства, отличающиеся от других групп элементов.
В основе атомной структуры щелочных металлов находится энергетический уровень, или слой, на котором находятся ионный радиус и внешняя электронная оболочка. Каждый элемент группы щелочных металлов имеет лишь один электрон на внешнем энергетическом слое. Это делает их электронно-донорными элементами и способными формировать ионные связи с другими элементами.
Наличие только одного электрона на внешнем энергетическом слое делает щелочные металлы очень реактивными и склонными к образованию ионов. Это связано с тем, что когда они теряют свой внешний электрон, то достигают наиболее стабильного состояния - наличия полностью заполненной оболочки.
В заключение можно сказать, что щелочные металлы имеют особенности своей атомной структуры, а именно наличие только одного электрона на внешнем энергетическом слое. Это обуславливает их высокую реактивность и способность к образованию ионных связей с другими элементами.
Элементы щелочных металлов

Щелочные металлы включают в себя химические элементы первой группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к самым активным металлам, так как обладают одним электроном на своем внешнем энергетическом слое.
Литий, первый элемент щелочных металлов, имеет атомный номер 3. В его внешнем энергетическом слое находится один электрон. Литий встречается в природе в виде ионов Li+, так как он легко отдает свой внешний электрон, чтобы образовать ион положительного заряда.
Натрий, второй элемент щелочных металлов, имеет атомный номер 11. У него также один электрон на внешнем энергетическом слое. Натрий широко распространен в природе и является необходимым элементом для живых организмов.
Калий, третий элемент щелочных металлов, имеет атомный номер 19. У него один электрон на внешнем энергетическом слое, что делает его очень реактивным. Калий является важным элементом для растений и животных.
Рубидий, четвертый элемент щелочных металлов, имеет атомный номер 37. У него также один электрон на внешнем энергетическом слое. Рубидий найти сложно, но он используется в некоторых научных и технических приложениях.
Цезий, пятый элемент щелочных металлов, имеет атомный номер 55. У него также один электрон на внешнем энергетическом слое. Цезий является редким элементом, но его соединения находят применение в электронике и науке.
Франций, последний элемент щелочных металлов, имеет атомный номер 87. У него также один электрон на внешнем энергетическом слое. Франций является очень редким и радиоактивным элементом, поэтому его свойства слабо изучены.
Структура атома и энергетические уровни

Структура атома является основой для понимания его свойств и взаимодействий с другими атомами. Атом состоит из ядра, которое содержит протоны и нейтроны, а также электронной оболочки, на которой находятся электроны.
Электроны размещаются на энергетических уровнях вокруг ядра. Каждый энергетический уровень может вмещать определенное количество электронов. Энергетический уровень, ближайший к ядру, называется первым, или внутренним. Каждый следующий уровень имеет более высокую энергию и называется вторым, третьим и т.д. Внешний энергетический уровень называется валентным.
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют одну валентную электрон на своем внешнем энергетическом слое. Это означает, что на этом уровне находится один электрон, который является ответственным за химические реакции и взаимодействия металла с другими веществами.
Валентный электрон, благодаря своей относительной удаленности от ядра, более свободно взаимодействует с другими атомами и может быть передан или принят другим атомом во время химической реакции. Это делает щелочные металлы очень реакционноспособными и способными образовывать множество химических соединений.
Внешний энергетический слой у щелочных металлов

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, характеризуются наличием одного электрона на своем внешнем энергетическом слое. Это делает их очень реактивными и легко вступающими в химические реакции. Один электрон на внешнем слое делает эти металлы очень электропроводными и способными образовывать ионы положительного заряда.
Электрон на внешнем энергетическом слое щелочных металлов может быть легко передан другому атому. Именно поэтому щелочные металлы образуют ионы Li+, Na+, K+ и т.д., теряя свой внешний электрон и становясь положительно заряженными. Такие положительно заряженные ионы легко взаимодействуют с отрицательно заряженными частицами, что делает щелочные металлы очень реактивными и хорошими веществами для разных химических процессов.
Свойство щелочных металлов иметь всего один электрон на внешнем энергетическом слое также связано с их расположением в периодической системе элементов. Щелочные металлы находятся в первой группе и первом периоде периодической системы, что указывает на их радиус атома и энергию связи.
Зависимость количества электронов на внешнем слое от номера группы
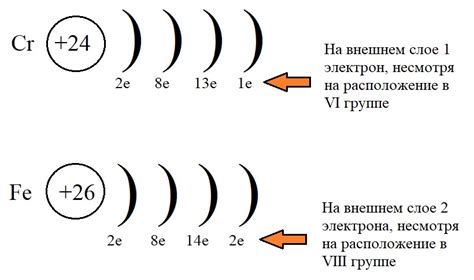
Щелочные металлы, которые находятся в первой группе периодической системы, включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают химическими свойствами, обусловленными наличием одного электрона на внешнем энергетическом слое. Этот электрон легко отделяется, что делает щелочные металлы очень реактивными.
По мере движения по периодической таблице, количество электронов на внешнем слое щелочных металлов увеличивается на один с каждой следующей группой. Например, у лития на внешнем энергетическом слое находится один электрон, у натрия - два, у калия - три, и так далее.
Количество электронов на внешнем слое щелочных металлов определяет их химические свойства. Эти металлы имеют тенденцию образовывать ион положительного заряда, отдавая свой последний электрон. Кроме того, они легко реагируют с водой и кислородом, образуя основания и оксиды соответственно.
Таким образом, количество электронов на внешнем энергетическом слое щелочных металлов является ключевым фактором, определяющим их химическую активность и важность в различных процессах химических реакций.
Электронная конфигурация щелочных металлов

Щелочные металлы - это элементы 1 группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий(Cs) и франций (Fr). Они характеризуются тем, что на их внешнем энергетическом слое содержится один электрон, имеющий наибольшую энергию среди всех электронов в атоме.
Электронная конфигурация щелочных металлов представляет собой упорядоченное перечисление энергетических уровней и подуровней, на которых располагаются электроны. Например, для лития электронная конфигурация будет выглядеть как 1s22s1, а для натрия - 1s22s22p63s1.
Эти элементы характеризуются высокой реактивностью, так как устремлены к заполнению внешнего энергетического слоя. Их валентные электроны легко участвуют в химических реакциях, что позволяет щелочным металлам образовывать ионы положительного заряда при взаимодействии с другими веществами.
На внешнем энергетическом слое у щелочных металлов преобладает s-электронная оболочка, что делает их более подвижными и способными проявлять металлические свойства. Химические свойства щелочных металлов определяются их электронной конфигурацией и готовностью отдать валентный электрон, чтобы достичь стабильной октетной конфигурации.
Вопрос-ответ

Сколько электронов на внешнем энергетическом слое содержит щелочные металлы?
У щелочных металлов на внешнем энергетическом слое содержится 1 электрон.
Какое количество электронов на внешнем энергетическом слое имеют щелочные металлы?
У щелочных металлов обычно на внешнем энергетическом слое находится один электрон.
