Щелочноземельные металлы - это группа элементов, которые находятся во второй группе периодической системы. Эти металлы включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они обладают общими особенностями, одной из которых является количество электронов на их внешнем энергетическом уровне.
Внешний энергетический уровень - это энергетический уровень с наивысшей энергией, на котором находятся электроны в атоме. У атомов щелочноземельных металлов внешний энергетический уровень содержит 2 электрона. Таким образом, каждый атом бериллия, магния, кальция, стронция, бария и радия имеет 2 электрона на своем внешнем энергетическом уровне.
Это знание является важным для понимания электронной структуры атомов щелочноземельных металлов и их химических свойств. Наличие 2 электронов на внешнем энергетическом уровне делает эти металлы химически активными, так как они стремятся передать или принять электроны, чтобы достичь стабильной октетной конфигурации.
Тестирование знаний по количеству электронов на внешнем энергетическом уровне атомов щелочноземельных металлов позволяет проверить понимание этой особенности и определить глубину знаний студента. Знание количества электронов на внешнем энергетическом уровне помогает в дальнейшем изучении свойств и реакций щелочноземельных металлов.
Сколько электронов на внешнем уровне в атоме щелочноземельных металлов

Электронная конфигурация атомов щелочноземельных металлов обычно имеет два электрона на внешнем энергетическом уровне. Все атомы этой группы элементов имеют химический символ M, где M обозначает металл. К щелочно-земельным металлам относятся атомы ионов, которые имеют два электрона на внешнем энергетическом уровне и положительные заряды.
На внешнем энергетическом уровне атома щелочноземельных металлов находится s-электрон. Это позволяет атому образовывать двойные связи с другими элементами, что обуславливает химическую реактивность щелочноземельных металлов. Благодаря наличию двух электронов на внешнем энергетическом уровне, атомы щелочноземельных металлов образуют стабильные соединения с другими элементами и играют важную роль в многих химических реакциях и процессах.
Итак, электронная конфигурация атомов щелочноземельных металлов в общем случае выглядит как ns2, где n обозначает номер энергетического уровня, а s обозначает s-электрон на внешнем уровне. Таким образом, щелочноземельные металлы обладают по два электрона на своем внешнем энергетическом уровне, что делает их химически активными и способными образовывать химические соединения с другими элементами.
Знания о строении атома
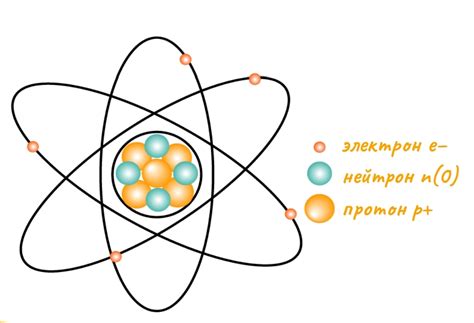
Атом - минимальная единица вещества, состоящая из ядра и электронной оболочки. Ядро атома содержит нейтроны и протоны, а электронная оболочка – электроны.
Электроны – элементарные частицы, обладающие отрицательным электрическим зарядом. Они находятся в постоянном движении по определенным орбитам вокруг ядра атома.
Наиболее удаленная от ядра электронная оболочка называется внешней энергетической оболочкой. Количество электронов на внешней энергетической оболочке определяет химические свойства атома и его взаимодействие с другими атомами.
Знание о строении атома позволяет объяснить химические реакции, определить валентность и распределение электронов в атоме. Важно учитывать, что все электроны не имеют одинаковой энергии, а занимают определенные энергетические уровни. Каждый энергетический уровень может вместить определенное количество электронов.
Для атомов щелочноземельных металлов характерно расположение двух электронов на внешней энергетической оболочке. Это делает их стабильными и склонными к химическим реакциям, направленным на отдачу этих двух электронов для достижения конфигурации инертного газа.
Химические свойства щелочноземельных металлов

Щелочноземельные металлы - это группа химических элементов, включающая бериллий, магний, кальций, стронций, барий и радий. Они обладают рядом уникальных химических свойств, которые делают их важными в различных областях науки и промышленности.
Одной из характеристик щелочноземельных металлов является их активность в химических реакциях. Они легко реагируют с кислородом и образуют оксиды. Например, магний соединяется с кислородом и образует оксид магния (MgO). Эти оксиды могут быть использованы в различных промышленных процессах, таких как производство стекла и керамики.
Щелочноземельные металлы также реагируют с водой. Например, кальций реагирует с водой, образуя гидроксид кальция (Ca(OH)2). Это свойство позволяет использовать щелочноземельные металлы для производства щелочей, которые являются важными компонентами в различных химических процессах.
Щелочноземельные металлы обладают также способностью образовывать ионы с положительным зарядом. Например, ион магния (Mg2+) может участвовать в различных биологических процессах и является необходимым питательным веществом для растений и животных.
В целом, химические свойства щелочноземельных металлов делают их неотъемлемыми компонентами в различных областях науки и промышленности, включая производство лекарств, генетику, электронику и многое другое.
Как влияет количество электронов на химические свойства

Количество электронов на внешнем энергетическом уровне атомов щелочноземельных металлов играет важную роль в их химических свойствах. Внешний энергетический уровень, или валентный уровень, содержит электроны, которые наиболее активно участвуют в химических реакциях и определяют химическую активность атомов.
Чем меньше количество электронов на внешнем энергетическом уровне, тем легче атом может отдать или поделить свои электроны с другими атомами. Это делает щелочноземельные металлы, такие как магний, кальций и барий, хорошими веществами для образования ионов с положительным зарядом. Благодаря своей способности образовывать ионы, эти металлы являются реактивными и могут образовывать различные соединения с другими элементами.
Увеличение количества электронов на внешнем энергетическом уровне ведет к увеличению силы притяжения этих электронов к ядру атома. Это делает атомы более устойчивыми и менее склонными к образованию ионов. Например, стронций и барий, имеющие два электрона на внешнем уровне, реагируют меньше, чем магний или кальций, у которых по два и один электрон(ы) на внешнем уровне соответственно.
Значение электронной конфигурации

Электронная конфигурация атома определяет расположение электронов на его энергетических уровнях. Она отражает количество электронов на каждом энергетическом уровне и в подуровнях, а также их спин и спаривание. Электронная конфигурация играет важную роль в химических свойствах атомов и используется для объяснения и предсказания их способности взаимодействовать с другими атомами.
Для щелочноземельных металлов, таких как магний, кальций и стронций, электронная конфигурация на внешнем энергетическом уровне определяется формулой ns2, где n - номер энергетического уровня. Именно электроны на внешнем энергетическом уровне определяют химическую активность атомов щелочноземельных металлов.
Наличие двух электронов на внешнем энергетическом уровне делает атомы щелочноземельных металлов химически активными, так как они стремятся отдать эти электроны для достижения стабильной октетной конфигурации. Благодаря этому свойству, щелочноземельные металлы являются хорошими восстановителями и образуют сильно щелочные оксиды и гидроксиды.
Знание электронной конфигурации помогает понять основные химические свойства щелочноземельных металлов и предсказать их взаимодействия с другими веществами. Более подробные сведения о конфигурации атомов вещества можно найти в периодической таблице элементов, которая представляет электронную конфигурацию каждого элемента и помогает в изучении и предсказании химических свойств веществ.
Использование спектроскопии для определения электронной конфигурации

Спектроскопия - это метод, который позволяет определить электронную конфигурацию атомов щелочноземельных металлов. Он основан на изучении спектров, которые возникают при взаимодействии электронов с электромагнитным излучением.
Спектроскопия позволяет получить информацию о распределении электронов по энергетическим уровням атома. Этот метод особенно полезен для изучения внешнего энергетического уровня, на котором находятся валентные электроны.
Для проведения спектроскопического анализа используются различные методы, такие как атомная спектроскопия, молекулярная спектроскопия и спектроскопия электронного парамагнитного резонанса. С помощью этих методов можно определить энергетические уровни атомов щелочноземельных металлов и установить количество электронов на их внешнем энергетическом уровне.
Электронная конфигурация атомов щелочноземельных металлов имеет особую важность, так как она влияет на химические свойства этих элементов. Знание электронной конфигурации позволяет предсказывать и объяснять реактивность и способность образовывать соединения данных элементов.
Значение взаимодействия электронов на внешнем энергетическом уровне
Внешний энергетический уровень атома щелочноземельных металлов содержит электроны, которые взаимодействуют друг с другом и с атомным ядром. Это взаимодействие имеет важное значение для свойств и химической активности этих металлов.
Взаимодействие электронов на внешнем энергетическом уровне определяет способность атома щелочноземельного металла принимать или отдавать электроны при химических реакциях. Число электронов на внешнем энергетическом уровне определяет его химическую активность. Щелочноземельные металлы имеют два электрона на внешнем энергетическом уровне, что делает их склонными к терянию электронов и образованию положительных ионов. Наличие двух электронов на внешнем энергетическом уровне также определяет их способность образовывать ковалентные связи с другими атомами.
Взаимодействие электронов на внешнем энергетическом уровне также влияет на физические свойства атомов щелочноземельных металлов. Например, электроны на внешнем энергетическом уровне создают электронные облака, которые взаимодействуют с электромагнитным излучением и определяют спектральный отклик металлов. Также взаимодействие электронов на внешнем энергетическом уровне влияет на их проводимость, теплопроводность и другие физические свойства.
Понимание значения взаимодействия электронов на внешнем энергетическом уровне атомов щелочноземельных металлов является важным для практического применения этих металлов в различных областях, включая электронику, катализ, энергетику и материаловедение.
Исследования, связанные с числом электронов на внешнем уровне
Число электронов на внешнем энергетическом уровне атомов щелочноземельных металлов является фундаментальным параметром для понимания их химической активности и свойств. Исследования, направленные на изучение этого параметра, имеют важное значение для развития различных областей науки и технологии.
Одним из методов определения числа электронов на внешнем уровне является спектроскопия электронного поглощения. Этот метод позволяет получить информацию о распределении электронных уровней и определить количество электронов, занимающих внешний энергетический уровень атома щелочноземельного металла.
Исследования, проведенные с использованием спектроскопии электронного поглощения, позволили установить, что атомы щелочноземельных металлов обладают одним или двумя электронами на своем внешнем энергетическом уровне. Например, у атома кальция (Ca) два электрона на внешнем уровне, а у атома магния (Mg) только один электрон.
Знание числа электронов на внешнем уровне атомов щелочноземельных металлов позволяет углубить понимание их химической реактивности и возможности взаимодействия с другими веществами. Также это знание находит практическое применение в различных областях, включая синтез материалов, разработку новых препаратов и технологий.
Тестирование знаний о количестве электронов в щелочноземельных металлах
Щелочноземельные металлы — это группа химических элементов, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они отличаются особой электронной конфигурацией и химическими свойствами.
Эти металлы имеют два энергетических уровня, на которых располагаются их электроны. Первый уровень, ближайший к ядру, может содержать не более 2 электронов, а второй уровень — не более 8 электронов. Таким образом, щелочноземельные металлы имеют 2 электрона на своем внешнем энергетическом уровне.
Знание количества электронов на внешнем энергетическом уровне щелочноземельных металлов является важной основой для понимания их химических свойств и реакций. Эти металлы обладают высокой реактивностью и способностью образовывать ионы с положительным зарядом.
Важно усвоить, что благодаря наличию двух электронов на внешнем энергетическом уровне, щелочноземельные металлы имеют устойчивость, которая определяет их отдельные химические свойства и способность принимать участие в различных реакциях.
Вопрос-ответ

Какое количество электронов на внешнем энергетическом уровне обычно имеют атомы щелочноземельных металлов?
Атомы щелочноземельных металлов обычно имеют 2 электрона на внешнем энергетическом уровне.
Почему атомы щелочноземельных металлов имеют 2 электрона на внешнем энергетическом уровне?
Атомы щелочноземельных металлов имеют 2 электрона на внешнем энергетическом уровне из-за своей электронной конфигурации. В атоме кальция (Ca), например, внешний энергетический уровень заполнен 2 электронами: 2S^2, где 2S обозначает энергетический уровень, а верхний индекс 2 обозначает количество электронов на этом уровне.
У всех ли щелочноземельных металлов одинаковое количество электронов на внешнем энергетическом уровне?
У всех щелочноземельных металлов количество электронов на внешнем энергетическом уровне равно 2. Например, у магния (Mg) и бария (Ba) также есть по 2 электрона на внешнем уровне, как и у кальция (Ca).
Почему число электронов на внешнем энергетическом уровне так важно для атомов щелочноземельных металлов?
Число электронов на внешнем энергетическом уровне важно для атомов щелочноземельных металлов, потому что это определяет их химические свойства. 2 электрона на внешнем уровне позволяют щелочноземельным металлам быть хорошими донорами электронов, поэтому они активно участвуют в химических реакциях и образуют ионные соединения.
Может ли количество электронов на внешнем энергетическом уровне атомов щелочноземельных металлов изменяться?
Количество электронов на внешнем энергетическом уровне атомов щелочноземельных металлов не может изменяться при обычных условиях. Это определено структурой атома и электронной конфигурацией. Однако, при определенных условиях, например, при высокой температуре или высоком давлении, возможно изменение электронной конфигурации и количества электронов.
