Взаимодействие металлов ведется на уровне их атомов и электронов. Когда два металла вступают в химическую реакцию, один металл может отдать электроны другому, образуя положительные и отрицательные ионы. Этот процесс называется ионизацией.
Количество электронов, которые металл может отдать другому металлу, зависит от его электронной конфигурации и относительных энергий уровней заполнения. Металлы стремятся достичь стабильности, обретая положительный или отрицательный заряд.
Например, алюминий имеет электронную конфигурацию 1s²2s²2p⁶3s²3p¹, что означает, что у него есть 3 свободных электрона на наружном уровне. Чтобы достичь стабильности, алюминий может отдать эти 3 электрона другому металлу. Если другой металл имеет конфигурацию 1s²2s²2p⁶3s²3p², то он может принять эти 3 электрона и образовать стабильную структуру.
Металлы в химии

Металлы представляют собой особую группу химических элементов, которые обладают высокой электропроводностью и теплопроводностью. Они являются основными строительными блоками множества веществ и материалов, используемых в различных сферах нашей жизни.
Металлы имеют способность отдавать электроны другим веществам, особенно неметаллам. Это свойство называется металлическим характером. Когда металл взаимодействует с неметаллом, он отдает электроны своей валентной оболочки, образуя положительные ионы, называемые катионами.
Количество электронов, которое металл отдает другому веществу, зависит от его атомного номера и расположения в периодической таблице. Чем ниже атомный номер у металла, тем меньше электронов он обычно отдает. Например, литий (Li) имеет один электрон на внешней оболочке и легко отдает его, образуя ион Li+.
Однако есть и исключения. Некоторые металлы могут образовывать различные ионы, отдавая разное количество электронов. Например, железо (Fe) может образовывать ионы Fe2+ и Fe3+, отдавая 2 или 3 электрона соответственно.
Использование металлов в химических реакциях и промышленности во многом связано с их способностью отдавать электроны и образовывать ионы с положительным зарядом. Это позволяет реализовать множество процессов, таких как электролиз, гальваническая коррозия, получение металлов из руды и т. д.
Что такое металл?

Металл – это химический элемент или сплав, обладающий способностью проводить электричество и тепло, а также обладать определенными механическими свойствами, такими как прочность и пластичность. Металлы имеют кристаллическую структуру, то есть их атомы расположены в регулярном трехмерном порядке.
Металлы обладают большой электропроводностью благодаря свободным электронам, которые перемещаются по кристаллической решетке металла. Кроме того, металлы обладают высокой теплопроводностью, что позволяет им эффективно отводить тепло. Благодаря этим свойствам, металлы широко применяются в различных отраслях промышленности, строительстве и электронике.
Одной из характерных особенностей металлов является их способность отдавать электроны другим элементам. Когда металл встречается с другим веществом, которое имеет большую силу электроотрицательности, металл может отдать свои электроны и образовать положительные ионы. Этот процесс называется ионизацией и играет важную роль в различных химических реакциях, включая окислительно-восстановительные реакции.
Металлы также могут образовывать сплавы, которые состоят из двух или более металлических элементов. Сплавы имеют улучшенные механические свойства по сравнению с отдельными металлами и широко применяются в промышленности для создания различных конструкций и изделий. Кроме того, сплавы могут иметь специальные свойства, такие как повышенная стойкость к коррозии или магнитные свойства.
Что такое электрон?

Электрон - это элементарная частица, обладающая отрицательным электрическим зарядом. Она является одной из составных частей атома, расположенной вокруг его ядра.
Электрон отвечает за электрический ток и электромагнитные поля. Он может двигаться вокруг ядра в различных энергетических состояниях, создавая облако негативного заряда вокруг атомного ядра.
Масса электрона очень мала - около 9,1 × 10^-31 килограмма. Он является одним из фундаментальных элементов частиц и входит в понятие элементарной частицы в физике.
Электроны также играют важную роль в химических реакциях. При взаимодействии атомов, электроны могут быть переданы от одного атома другому, образуя химическую связь и обеспечивая стабильность молекулы.
Электроны в металлах
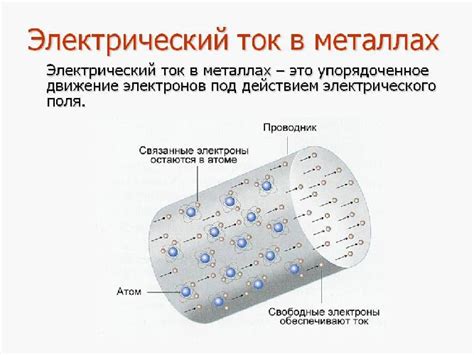
Электроны играют важную роль в химических реакциях металлов и определяют их химические свойства. Металлы хорошо проводят электричество и тепло, и это связано с их особыми свойствами электронной структуры.
Электроны металлов находятся в так называемой "электронной оболочке". Оболочка состоит из нескольких энергетических уровней, на которых расположены электроны в виде электронных облаков или орбиталей. Обычно на наиболее внешнем уровне находятся электроны, с которыми взаимодействуют при химических реакциях. Эти электроны называют валентными.
Когда металл вступает в химическую реакцию с другим металлом, один из них может отдать электроны другому. Количество электронов, которые металл отдаст или примет, зависит от его валентности. Валентность металла определяется количеством валентных электронов на наиболее внешнем энергетическом уровне.
Что такое отдача электронов?

Отдача электронов - это процесс, при котором один металл передает электроны другому металлу. Электроны являются негативно заряженными элементарными частицами, которые находятся вокруг ядра атома. В металлах электроны могут свободно перемещаться между атомами, образуя электронное облако. При отдаче электронов металлы обмениваются лишними электронами, что может происходить при взаимодействии различных сплавов или при электрических контактах.
Отдача электронов играет важную роль в различных процессах заземления, электролиза, а также в химическом и электротехническом производстве. Электроны могут передаваться от одного атома к другому при помощи электрического поля или в результате химических реакций. В процессе отдачи электронов металлы могут изменять свои структурные и электрические свойства, что может быть использовано в различных технологиях и промышленных процессах.
Отдача электронов также может происходить в электрохимических реакциях, где металлы могут служить как аноды и катоды. При этом анод, который отдаёт электроны, окисляется, а катод, который принимает электроны, восстанавливается. Эти реакции могут происходить в различных электролитах и являются основой работы аккумуляторов, элементов железнодорожных контактной сети, а также других электрических устройств.
Как электроны отдаются металлом?

Металлы являются хорошими проводниками электричества, и их основным свойством является способность отдавать электроны другим атомам или ионам. Этот процесс, называемый оксидацией, происходит за счет способности атомов металла потерять электроны из своей внешней оболочки.
Электроны в металлах находятся в свободном состоянии и могут перемещаться вдоль кристаллической решетки. Когда металл контактирует с другим металлом или веществом, которому требуются электроны, атомы металла могут отдать электроны этим атомам или ионам. Таким образом, атомы металла становятся положительно заряженными ионами или катионами, а вещество, получившее электроны, становится отрицательно заряженными ионами или анионами.
Количество электронов, которое отдают атомы металла, зависит от их химических свойств и энергетического состояния. Величина заряда, который металл может отдать, определяется его положением в таблице активности металлов. Например, щелочные металлы, такие как литий и натрий, способны отдать один электрон, в то время как переходные металлы могут отдать несколько электронов в зависимости от своего энергетического состояния.
Процесс отдачи электронов металлом является важным в различных химических реакциях и процессах, таких как коррозия металлов и электролиз. Понимание этого процесса позволяет контролировать взаимодействие металлов с другими веществами и использовать их свойства в различных технологических процессах и промышленных приложениях.
Какое количество электронов может отдать металл другому?
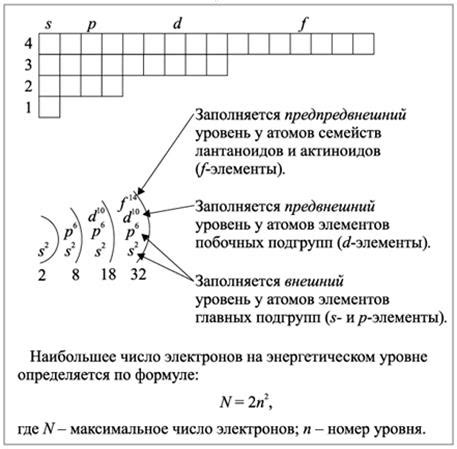
Металлы, как правило, имеют склонность отдавать электроны и образовывать положительно заряженные ионы. Количество электронов, которые металл может отдать другому металлу или не металлу, зависит от его электронной конфигурации и положения в периодической таблице.
Внешний электронный слой металла, называемый валентным, играет важную роль в определении его способности отдавать электроны. Металлы из группы 1 периодической таблицы, такие как литий и натрий, имеют один валентный электрон и могут отдать его, чтобы образовать положительно заряженное ионное соединение. Металлы из группы 2, такие как магний и кальций, имеют два валентных электрона и могут отдать их образовывая соединения с двумя отрицательно заряженными ионами.
Однако, более переходные металлы из д-блока периодической таблицы имеют сложную электронную конфигурацию и способность отдавать разное количество электронов в разных химических соединениях. Например, железо может отдать два или три электрона в различных реакциях, образуя соединения с разным зарядом.
Общее количество электронов, которое металл может отдать другому металлу или не металлу, может быть определено на основе его валентности и положения в периодической таблице. Электроны, отдаваемые металлом, играют важную роль в образовании химических связей и создании различных соединений. Эта способность металлов отдавать электроны используется в различных химических процессах и реакциях.
Примеры металлов, отдающих электроны

Натрий: Натрий (Na) является хорошим примером металла, который отдает электроны. Во внешнем электронном слое натрия находится всего один электрон, что делает его атом нестабильным. Поэтому натрий легко отдает этот электрон другому металлу или не металлу, чтобы достичь стабильной электронной конфигурации. Натрий широко используется в различных промышленных процессах и в химической промышленности.
Стронций: Стронций (Sr) также является металлом, который может отдавать электроны. Он находится во второй группе периодической таблицы и имеет 2 электрона во внешнем электронном слое. Стронций может отдать эти два электрона и стать положительно заряженным ионом, Sr2+. Ион стронция широко применяется в различных областях, включая производство стекла и пиротехнику.
Калий: Калий (K) является еще одним примером металла, отдающего электроны. Он находится в первой группе периодической таблицы и имеет всего один электрон во внешнем электронном слое. Калий может легко отдать этот электрон и стать положительно заряженным ионом, K+. Калий часто используется в сельском хозяйстве для удобрений, а также в производстве стекла и мыльных изделий.
Кальций: Кальций (Ca) также относится к металлам, способным отдавать электроны. У него на внешнем электронном уровне находятся два электрона. Кальций часто отдает эти электроны, чтобы стать положительно заряженным ионом, Ca2+. Это делает кальций одним из самых распространенных элементов в земной коре и организме живых существ.
Алюминий: Алюминий (Al) является металлом, который также способен отдавать электроны. У него на внешнем электронном уровне находятся три электрона. Алюминий легко отдает один из этих электронов, чтобы стать положительно заряженным ионом, Al3+. Алюминий широко используется в строительстве, промышленности и производстве упаковочных материалов.
Вопрос-ответ

Как происходит передача электронов от одного металла к другому?
Передача электронов от одного металла к другому происходит при образовании химической связи между ними. Металл, отдающий электроны, становится положительно заряженным и образует ион, называемый катионом. Металл, принимающий электроны, становится отрицательно заряженным и образует ион, называемый анионом. Количество электронов, которое отдает металл другому металлу, зависит от их электроотрицательности и орбитальной конфигурации электронов.
Сколько электронов может отдать металл другому металлу?
Количество электронов, которое металл может отдать другому металлу, зависит от его внешней электронной оболочки и орбитальной конфигурации электронов. Некоторые металлы могут отдать только один электрон, например натрий (Na), который обладает одним электроном на своей внешней электронной оболочке. Другие металлы, такие как алюминий (Al) и железо (Fe), могут отдать по несколько электронов. Точное количество электронов, которое может быть отдано, зависит от конкретных химических реакций и условий.
