Щелочные металлы представляют собой группу элементов, расположенных в первой группе (группе 1) периодической системы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы имеют общую характеристику - наличие одного электрона на внешнем электронном слое, что делает их особенно реактивными.
Количество электронов на внешнем электронном слое у щелочных металлов определяется их положением в периодической системе. Все щелочные металлы имеют одну валентную электронную оболочку, что делает их очень реактивными и легко взаимодействующими с другими веществами. Этот электрон на внешнем слое может быть потерян или передан другому веществу в процессе химической реакции.
Количество электронов на внешнем электронном слое является важной характеристикой щелочных металлов, так как оно определяет их химические свойства и способность образовывать связи с другими элементами. Обычно эти элементы стремятся отдать этот один электрон и образовать положительный ион, что позволяет им образовывать ионы с отрицательно заряженными элементами и создавать разнообразные соединения.
В общей таблице химических свойств элементов щелачной группы можно увидеть, что каждый следующий щелочный металл имеет на один электрон больше на внешней оболочке по сравнению с предыдущим. Это отношение между количеством электронов на внешнем электронном слое и положением элемента в периодической системе является закономерным и позволяет делать выводы о его химических свойствах и реактивности.
Щелочные металлы и количество электронов на внешнем электронном слое:
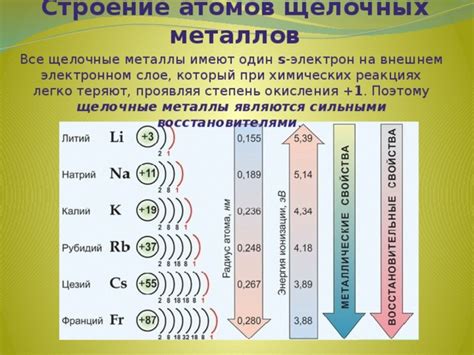
Щелочные металлы - это группа элементов в периодической таблице, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы имеют общую характеристику - наличие одного электрона на внешнем электронном слое (также известном как валентная оболочка или валентная электронная оболочка).
Количество электронов на внешнем электронном слое играет важную роль в химических свойствах щелочных металлов. Валентный электрон, расположенный на внешней оболочке, легко участвует в химических реакциях и формирует ион с положительным зарядом.
Например, у лития (Li) на внешней оболочке находится один электрон. Способность этого электрона легко отдаться другому атому делает литий реактивным элементом, способным быстро связываться с другими элементами. Также, структура атома лития приводит к тому, что соли лития обладают уникальными свойствами, которые нашли применение в медицине, электронике и других отраслях.
У остальных щелочных металлов, таких как натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), на внешней оболочке также располагается один электрон. Это дает им схожие химические свойства, их легко ионизировать, образуя однозарядные катионы.
Количество электронов на внешней оболочке щелочных металлов является важным при определении их свойств и химической активности. Они обладают высокой реактивностью и способностью образовывать ионы. Это делает их ценными в химической, медицинской и промышленной областях.
На что влияет количество электронов на внешнем электронном слое у щелочных металлов

Внешний электронный слой у щелочных металлов играет важную роль в их химических свойствах. Количество электронов на этом слое определяет реакционную активность и способность этих металлов образовывать ионы.
Ущелочных металлов, таких как литий, натрий и калий, на внешнем слое содержится один электрон. Этот одиночный электрон легко переходит в другие валентные энергетические оболочки при вступлении в химическую реакцию, что приводит к образованию положительных ионов с единичным зарядом.
Количество электронов на внешнем электронном слое влияет на реакционную способность щелочных металлов. Более высокое количество электронов на внешнем слое, как у цезия и франция, делает эти металлы более реакционноспособными в сравнении с литием, натрием и калием. Они имеют больше электронов, которые могут участвовать в реакциях с другими веществами.
Количество электронов во внешнем электронном слое также определяет металлические свойства щелочных металлов. Электроны на внешнем слое способствуют образованию металлической связи, которая отвечает за хорошую теплопроводность, электропроводность и пластичность щелочных металлов.
В связи с этим, количество электронов на внешнем электронном слое у щелочных металлов играет ключевую роль в их химических и физических свойствах, определяя их активность, электропроводность, теплопроводность и другие характеристики. Применение щелочных металлов в различных областях, от электрохимии до медицины, тесно связано с их уникальными свойствами, которые зависят от количества электронов на внешнем слое.
Вопрос-ответ

Какое количество электронов у щелочных металлов на внешнем электронном слое?
У всех щелочных металлов (литий, натрий, калий, рубидий, цезий, франций) на внешнем электронном слое находится по одному электрону.
Почему у щелочных металлов на внешнем электронном слое находится только один электрон?
Это связано с особенностями строения атомов щелочных металлов. У них внешний электронный слой содержит один электрон, чтобы достичь наиболее стабильного энергетического состояния.
Какое значение имеет внешний электрон для химических свойств щелочных металлов?
Внешний электрон щелочных металлов играет роль в химических реакциях и определяет их химические свойства. Этот электрон легко отделяется от атома щелочного металла, поэтому эти металлы обладают высокой химической активностью и способностью образовывать ионы с положительным зарядом.
Может ли количество электронов на внешнем электронном слое щелочных металлов изменяться?
Количество электронов на внешнем электронном слое щелочных металлов может изменяться при взаимодействии с другими элементами. Например, в реакции с хлором натрий отдает свой внешний электрон, образуя ион Na+, у которого на внешнем электронном слое отсутствуют электроны.
