Количество электронов на внешнем энергетическом уровне является одним из важных параметров, определяющих свойства атомов металлов. Внешний слой электронов, также известный как валентная оболочка, играет решающую роль в химических реакциях и взаимодействии металла с другими элементами и соединениями.
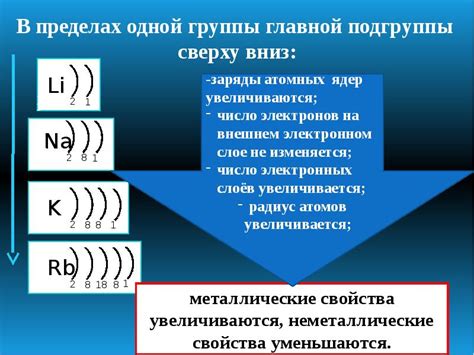
У атомов металлов в валентной оболочке находится от 1 до 3 электронов. Количество этих электронов определяет тип взаимодействия атома металла с другими элементами и его способность образовывать ионы положительной заряды.
Ионизационная энергия, то есть энергия, необходимая для удаления электрона с валентной оболочки атома металла, тесно связана с количеством электронов на внешнем слое. Чем меньше это количество, тем меньше энергии требуется для удаления электрона, и тем выше активность металла.
Металлы с двумя электронами на внешнем слое, например, кальций или магний, активные вещества, способные образовывать ионы с двойным зарядом. Отсюда их способность образовывать стабильные соединения, ценность и применение в различных областях промышленности.
Количество электронов на внешнем слое также связано с теплоемкостью металлов и их термической проводимостью. Это объясняет способность металлов отдавать и принимать тепло, а также их электропроводность.
Таким образом, количество электронов на внешнем слое у атомов металлов играет важную роль в их физических и химических свойствах. Понимание этой характеристики помогает в разработке новых материалов и продуктов с определенными свойствами и применениями в различных отраслях экономики.
Атомы металлов и их структура
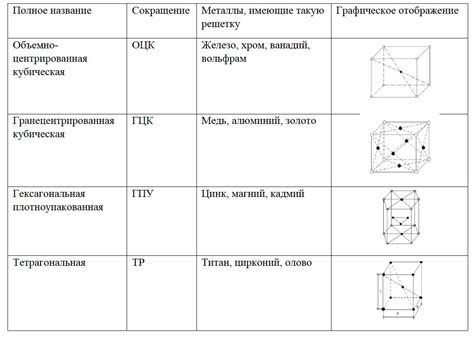
Атомы металлов - это основные строительные блоки всех металлических материалов. Они имеют сложные структуры, состоящие из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны, а электронная оболочка находится вокруг ядра и состоит из электронов.
На внешнем слое атома металла располагаются валентные электроны. Именно количество валентных электронов на внешнем слое определяет химические свойства металлов. Валентные электроны отвечают за формирование связей между атомами и взаимодействие с другими элементами. Важно отметить, что количество валентных электронов у атомов металлов обычно невелико по сравнению с общим числом электронов.
Структура атомов металлов имеет многочисленные свойства, которые делают их пригодными для широкого спектра применений. Отличительными особенностями атомов металлов являются их высокая проводимость тепла и электричества, а также способность образовывать легко деформируемые кристаллические решетки. Благодаря этим свойствам, металлы широко используются в различных областях, включая машиностроение, электротехнику, строительство и другие сферы.
Таким образом, понимание структуры атомов металлов и их свойств позволяет не только лучше понять химические процессы, но и разрабатывать новые материалы с улучшенными свойствами.
Внутренние электронные оболочки

Внутренние электронные оболочки атомов металлов представляют собой группу электронов, находящихся на более близком к ядру уровне энергии. Они образуют ядро атома вместе с ядерными электронами и обуславливают его химические свойства.
Количество электронов на внутренних оболочках атомов металлов может быть различным в зависимости от атомного номера элемента и его электронной конфигурации. Обычно внутренняя оболочка заполняется полностью до того момента, как начинают заполняться внешние оболочки. Это связано с тем, что электроны на внутренних оболочках обладают более низкой энергией и более сильно связаны с ядром атома.
Внутренние электронные оболочки влияют на свойства металлов, например, на их плотность, температуру плавления и твердость. Большинство металлов обладает высокой плотностью и твердостью, что объясняется прочными связями между электронами на внутренних оболочках и ядром атома. Кроме того, внутренние электронные оболочки могут влиять на степень ионизации металлов, что определяет их способность образовывать ионы и участвовать в химических реакциях.
Таблица 1 показывает количество электронов на внутренних оболочках некоторых металлов в порядке возрастания атомного номера. Эта информация может быть полезна для изучения зависимостей между количеством электронов на внутренних оболочках и химическими свойствами металлов.
| Металл | Количество электронов на внутренних оболочках |
|---|---|
| Литий (Li) | 2 |
| Натрий (Na) | 10 |
| Магний (Mg) | 10 |
| Алюминий (Al) | 18 |
| Цинк (Zn) | 18 |
Распределение электронов на внешнем слое
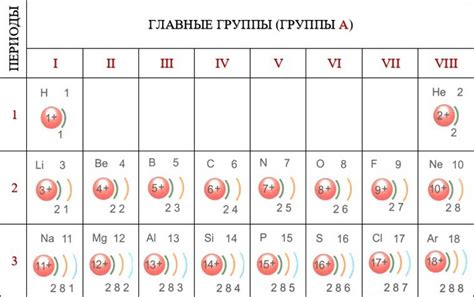
Распределение электронов на внешнем энергетическом уровне атомов металлов играет важную роль в их химических и физических свойствах. Внешний энергетический уровень называется также валентным уровнем или внешней оболочкой.
Валентные электроны обладают высокой энергией и, благодаря своей наибольшей удаленности от ядра, они определяют химическую активность атома металла. Количество электронов на внешнем слое может быть различным для разных металлов и зависит от расположения элемента в периодической системе.
Большинство металлов имеют одну или две электронные оболочки на своем внешнем слое. Например, атом натрия на внешнем слое имеет один электрон, а атом кальция - два электрона. Это делает эти металлы химически активными, так как они стремятся отдать эти электроны и образовать положительный ион.
Однако, существуют также металлы, у которых внешняя оболочка содержит более двух электронов. Например, у атома железа на внешнем слое находятся два электрона. Благодаря этому, железо может образовывать не только положительные, но и отрицательные ионы, вступая в различные химические реакции.
Распределение электронов на внешнем слое влияет на множество свойств металлов, включая их электропроводность, пластичность, теплопроводность и способность образовывать соединения. Это связано с тем, что электроны на внешнем слое образуют электронное облако, которое может свободно двигаться и выступать в роли электрического тока.
Роли электронов на внешнем слое
Электроны на внешнем слое атома металла играют ключевую роль в его химических и физических свойствах. Внешний слой электронов, также известный как валентная оболочка, содержит электроны, которые могут участвовать в химических реакциях и формировании химических связей с другими атомами. Эти внешние электроны определяют, как атомы металла взаимодействуют с окружающими газами или другими элементами.
Одним из наиболее важных свойств электронов на внешнем слое является их способность образовывать металлическую связь. В металлах внешние электроны не тесно связаны с ядром и могут свободно перемещаться по всему кристаллическому решетчатому строению. Это позволяет металлам обладать характерными физическими свойствами, такими как электрическая и теплопроводность, пластичность и отсутствие прозрачности для видимого света.
Количество электронов на внешнем слое также может влиять на химическую реактивность атомов металла. Атомы металла, имеющие малое количество электронов на внешнем слое, могут легко отдать или передать электроны другим атомам, образуя ионы. Это делает такие металлы хорошими проводниками электричества и ионами в растворах. Напротив, атомы металла, имеющие полное внешнее слои электронов, обычно не реагируют химически и обладают низкой реактивностью.
Некоторые атомы металлов могут иметь несколько электронов на внешнем слое. В этом случае эти электроны могут образовывать различные химические связи с другими атомами, что позволяет атомам образовывать различные соединения и сочетания с другими элементами. Например, атомы железа имеют два электрона на внешнем слое и могут образовывать как ион Fe2+ (потеря одного электрона), так и ион Fe3+ (потеря двух электронов), которые имеют различные свойства и соединения.
Влияние внешней оболочки на свойства металлов

Внешняя оболочка атома металла играет ключевую роль в определении его химических и физических свойств. Количество электронов на внешнем слое атома, также называемом валентной оболочкой, определяет его активность и способность к образованию соединений.
Металлы в основном имеют несколько электронов на своей внешней оболочке, что делает их хорошими проводниками тока и тепла. В сочетании с их добротностью, металлы обладают высокой электропроводностью и теплоотдачей, что делает их идеальными материалами для различных промышленных и технических приложений.
Свойства металлов связаны с их способностью отдавать или принимать электроны на внешней оболочке. Взаимодействие атомов металла происходит за счет электронного облача, образованного электронами на валентной оболочке. Это обеспечивает их высокую пластичность и деформируемость, позволяя металлам принимать различные формы без разрушения структуры.
Кроме того, внешняя оболочка определяет химическую реактивность металлов. Электроны на валентной оболочке могут легко переходить на другие атомы, образуя ионное или ковалентное соединение. Это позволяет металлам образовывать различные сплавы и соединения с другими элементами, расширяя их применение и функциональные свойства.
Все эти химические и физические свойства металлов напрямую зависят от количества электронов на внешнем слое и их распределения. Изменение внешней оболочки путем добавления или удаления электронов может влиять на магнитные, теплопроводящие, коррозионные и другие свойства металлов. Поэтому изучение внешней оболочки и ее влияния на свойства металлов имеет большое значение для развития новых материалов и улучшения их характеристик.
Устойчивость электронной оболочки
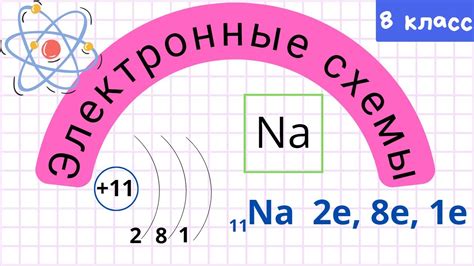
Устойчивость электронной оболочки атомов металлов определяется количеством электронов на их внешнем слое. Эта оболочка, называемая валентной, содержит электроны, которые имеют наибольшую энергию и отвечают за химические свойства атомов металлов. Количество электронов на внешнем слое определяет степень устойчивости оболочки и способность атомов образовывать соединения и проводить электрический ток.
Обычно атомы металлов стремятся достичь электронной конфигурации, аналогичной электронной конфигурации инертных газов – группы веществ, обладающих высокой устойчивостью благодаря полностью заполненной валентной оболочке. Для этого атомы металлов могут отдавать или принимать электроны, чтобы достичь полностью заполненной или пустой валентной оболочки.
Количество электронов на внешнем слое обычно соответствует номеру группы, в которой находится элемент в периодической системе Менделеева. Например, у металла второй группы будет два электрона на внешнем слое. Это отражает закономерность в распределении электронов в атомах металлов и позволяет предсказывать их химические свойства.
Устойчивость электронной оболочки атомов металлов также определяется их валентностью – способностью образовывать соединения с другими элементами. Металлы с полностью заполненной валентной оболочкой обычно обладают низкой валентностью и малой активностью в химических реакциях. С другой стороны, металлы с неполностью заполненной валентной оболочкой обладают более высокой валентностью и большей активностью в химических реакциях.
Изменение количества электронов на внешнем слое
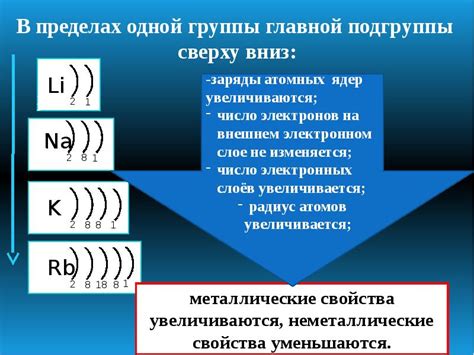
Количество электронов на внешнем слое у атомов металлов не является постоянным и может изменяться в зависимости от различных факторов. Одним из таких факторов является валентность металла, которая определяет количество электронов на внешнем слое.
Валентность металла зависит от его электронной конфигурации и сродства к электронам. Металлы с низкими значениями сродства к электронам имеют небольшое количество электронов на внешнем слое и, следовательно, низкую валентность. Наоборот, металлы с высокими значениями сродства к электронам имеют большое количество электронов на внешнем слое и высокую валентность.
Изменение количества электронов на внешнем слое может влиять на свойства металла. Например, увеличение количества электронов на внешнем слое может привести к увеличению межатомных взаимодействий и крепости металлической связи. Это может сказаться на физических свойствах металла, таких как температура плавления, теплопроводность и электропроводность.
Количество электронов на внешнем слое также может влиять на химические свойства металла. Металлы с определенными количествами электронов на внешнем слое могут быть более или менее активными в химических реакциях. Например, металлы с одним или двумя электронами на внешнем слое могут быть склонны к потере этих электронов и образованию положительно заряженных ионов. Такие металлы могут быть хорошими окислителями.
Практическое применение данного явления

Распределение количества электронов на внешнем слое у атомов металлов имеет ряд практических применений, которые находят свое применение в различных сферах науки и техники.
Одним из наиболее распространенных применений данного явления является производство различных типов аккумуляторов и батарей. Здесь количество электронов на внешнем слое металла позволяет хранить и переносить электрический заряд. Так, например, литиевые и никелевые аккумуляторы генерируют электрическую энергию благодаря изменению распределения электронов на внешнем слое металла.
Другим применением данного явления является использование его в электронике при создании полупроводниковых материалов и устройств. Например, в процессе создания транзисторов, основного элемента современной электроники, используется контроль и изменение количества электронов на внешнем слое металла. Это позволяет управлять прохождением электрического тока и создавать различные логические схемы.
Кроме того, распределение электронов на внешнем слое металлов имеет значение при создании металлокомплексных соединений. Такие соединения играют важную роль в химической промышленности и используются в различных процессах, включая катализ и синтез органических соединений.
Вопрос-ответ

Какое количество электронов на внешнем слое обычно имеют атомы металлов?
Атомы металлов обычно имеют от 1 до 3 электронов на внешнем слое.
Почему атомы металлов имеют такое количество электронов на внешнем слое?
Количество электронов на внешнем слое атомов металлов определяется их электронной конфигурацией и расположением в периодической системе. На внешнем слое находятся электроны, которые обеспечивают металлургические свойства металлов - высокую проводимость электротока и тепло, например.
Какие свойства имеют атомы металлов с разным количеством электронов на внешнем слое?
Атомы металлов с разным количеством электронов на внешнем слое имеют различные химические и физические свойства. Например, атомы металлов с одним электроном на внешнем слое имеют большую активность и склонность образовывать положительные ионы. Атомы металлов с двумя или тремя электронами на внешнем слое имеют меньшую активность и часто образуют соединения с другими элементами.
