Щелочные металлы - это особая группа элементов периодической системы, которая известна своими удивительными свойствами. Они внушают сверхспособности, которые похожи на героические качества фантастических персонажей.
Литий, первый элемент группы щелочных металлов, обладает уникальной способностью к образованию стабильных соединений с другими элементами. Это делает его незаменимым в области разработки новых материалов и технологий. Он также используется в лекарствах и электронных устройствах, благодаря своей способности быстро взаимодействовать с другими веществами.
Калий, второй элемент группы, известен своими взрывными свойствами. В сочетании с кислородом, калий может создавать яркие вспышки, что делает его незаменимым в пиротехнике. Кроме того, калий используется в сельском хозяйстве для повышения плодородия почвы и роста растений.
Натрий, третий элемент группы, имеет уникальное свойство быстро реагировать с водой, производя химическую реакцию, известную как гидролиз. Это свойство делает его идеальным для использования в промышленности и производстве энергии. Натрий также занимает важное место в нашем организме, контролируя уровень жидкости и кровяное давление.
Щелочные металлы - это настоящие сказочные герои с необычными сверхспособностями. Их способности взаимодействовать с другими элементами, создавать яркие вспышки и генерировать энергию делают их незаменимыми в различных областях нашей жизни. Они продолжают удивлять нас и быть источником вдохновения для новых открытий.
Сказочные сверхспособности щелочных металлов
Щелочные металлы - это группа элементов периодической таблицы, которые обладают удивительными свойствами. Калий, натрий, литий и другие щелочные металлы не только широко используются в промышленности и научных исследованиях, но и обладают некоторыми сказочными сверхспособностями.
Одной из наиболее известных сверхспособностей щелочных металлов является их способность реагировать с водой. Когда щелочный металл попадает в контакт с водой, происходит взрывообразная реакция, сопровождающаяся выделением газа и образованием щелочной соли. Такая реакция часто называется "горение металла в воде" и может быть впечатляющим зрелищем для наблюдателей.
Еще одной удивительной сверхспособностью щелочных металлов является их способность выделяться из расплавленной лавы в виде красивых ярких пламенных вспышек. Это связано с их способностью взаимодействовать с кислородом в воздухе и образовывать пламя. Такие яркие световые эффекты добавляют сказочности в ночное время при извержениях вулканов и в других природных явлениях.
Также щелочные металлы обладают сказочными сверхспособностями в химии. Они легко реагируют с другими веществами, что делает их незаменимыми в различных химических процессах. Например, калий может использоваться для получения взрывчатых веществ, литий - для производства легких и прочных материалов, натрий - для получения различных стекол.
Таким образом, сверхспособности щелочных металлов делают их неотъемлемой частью нашей жизни. Они не только помогают нам в решении различных технологических задач, но и придают сказочность некоторым природным и химическим процессам, делая их настоящими чудесами света и взрывных эффектов.
История открытия и особенности

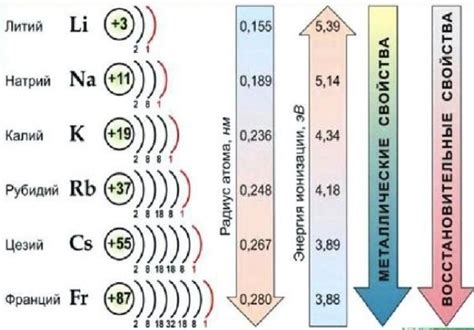
Щелочные металлы - это группа элементов периодической системы, включающих литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Их открытие связано с работой различных ученых, которые проводили исследования в XIX веке.
Первым щелочный металл был открыт в 1817 году французским химиком Антуаном Лавуазье. Он назвал его "литием" и опубликовал результаты своих исследований. Позже были открыты и другие щелочные металлы, такие как натрий, калий и рубидий.
Особенностью щелочных металлов является их реакционная способность с водой. При контакте с водой они активно реагируют, выделяя водород. Также щелочные металлы хорошо проводят тепло и электричество, и они мягкие, что дает им возможность быть нарезанными ножом или легко изменять форму.
Литий, наиболее легкий и редкий из щелочных металлов, обладает сверхспособностями, которые используются в различных областях. Например, литий-ионные аккумуляторы, основанные на этом элементе, широко применяются в портативных электронных устройствах и электромобилях. Без них наши смартфоны не могли бы работать так долго без подзарядки. Литий также используется в производстве лекарственных препаратов для лечения биполярного расстройства и других психических заболеваний.
Особенности щелочных металлов позволяют им играть важную роль в нашей повседневной жизни и современных технологиях, делая их бесценными веществами в научных и промышленных отраслях. Они продолжают быть исследуемыми учеными, и возможно, еще больше сказочных сверхспособностей щелочных металлов будет открыто в будущем.
Свойства щелочных металлов

Щелочные металлы - это группа химических элементов периодической системы, которая включает литий, натрий, калий, рубидий, цезий и франций. У этих металлов есть ряд уникальных свойств, которые делают их особенными.
Первое свойство щелочных металлов - низкая температура плавления и кипения. Например, литий плавится при температуре всего 180 градусов Цельсия, а натрий - при 97,8 градусах. Это делает щелочные металлы полезными для использования в различных технических и промышленных процессах.
Второе свойство щелочных металлов - высокая реактивность. Щелочные металлы активно взаимодействуют с водой, кислородом и другими веществами. Они легко окисляются и образуют ионы положительного заряда. Из-за своей высокой реактивности, щелочные металлы обычно хранятся под слоем раствора покрытием, чтобы предотвратить их контакт с воздухом.
Третье свойство щелочных металлов - высокая проводимость электричества. Щелочные металлы являются отличными проводниками электричества. Они имеют высокую электропроводимость, которая делает их неотъемлемой частью производства аккумуляторов и других электронных устройств.
Четвертое свойство щелочных металлов - образование характерных соединений. Щелочные металлы образуют разнообразные химические соединения. Например, хлорид натрия, или каменная соль, является одним из наиболее известных соединений натрия. Такие соединения обладают уникальными свойствами и широко используются в различных отраслях промышленности и науки.
Применение в современных технологиях

Сверхспособности щелочных металлов находят широкое применение в современных технологиях. Например, натрий используется в батареях. Батареи на основе щелочных металлов имеют высокую энергоемкость и способны работать на протяжении длительного времени без необходимости частой замены.
Калий, в свою очередь, является важным компонентом удобрений. Благодаря своим уникальным свойствам, калий способствует росту и развитию растений, повышает их устойчивость к болезням и стрессовым ситуациям.
Литий, как один из самых легких металлов, используется в производстве легких и прочных сплавов, а также в батареях для портативной электроники, таких как мобильные телефоны и ноутбуки.
Цезий нашел применение в современной электронике, например, в процессорах и футуристических квантовых компьютерах. Его уникальные свойства делают цезий незаменимым материалом для создания высокоточных элементов электроники.
Франций, самый редкий и радиоактивный щелочной металл, применяется в научных исследованиях, в частности, в ядерной физике и радиоактивных исследованиях. Его уникальные радиоактивные свойства позволяют использовать его в ряде приложений, включая диагностическую медицину.
Сверхспособности щелочных металлов открывают новые горизонты в различных областях технологий и науки. Их уникальные свойства и широкий спектр применения делают их ценными и востребованными материалами в современном мире.
Опасности и меры предосторожности при работе с щелочными металлами
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают рядом уникальных свойств и могут вызывать опасность при неправильном обращении с ними. При работе с этими веществами необходимо соблюдать определенные меры предосторожности.
Первая и наиболее очевидная опасность связана с их реакцией с водой и влагой. При контакте щелочных металлов с водой происходит интенсивное выделение водорода, что может вызвать взрывоопасную ситуацию. Поэтому при работе с щелочными металлами нужно избегать контакта с водой и хранить их в специальных герметичных контейнерах.
Другая опасность связана с реакцией щелочных металлов с кислородом в воздухе. Они могут воспламеняться при контакте с кислородом, поэтому важно хранить их в сухом месте и избегать ненужного контакта с воздухом. Также при работе с щелочными металлами необходимо быть осторожным и избегать попадания искр или пламени рядом с ними.
Важно помнить о том, что щелочные металлы являются коррозионно-активными и могут вызывать серьезные ожоги на коже. Поэтому при работе с ними необходимо использовать защитные перчатки и средства индивидуальной защиты. В случае попадания щелочного металла на кожу следует немедленно смыть его водой и обратиться за медицинской помощью.
Также следует учитывать, что щелочные металлы очень реактивны и могут вызывать взрывы при контакте с некоторыми веществами, такими как хлор или бром. Поэтому при работе с щелочными металлами необходимо быть осторожным и избегать их попадания на другие химические вещества.
В итоге, работа с щелочными металлами требует особой осторожности и соблюдения определенных мер предосторожности. Необходимо избегать контакта с водой и кислородом, использовать средства индивидуальной защиты и быть предельно осторожными при обращении с этими опасными веществами.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это группа элементов в периодической таблице, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), и франций (Fr). Они называются щелочными, потому что они реагируют с водой, образуя щелочные растворы.
Какие сверхспособности имеют щелочные металлы?
Щелочные металлы обладают несколькими удивительными сверхспособностями. Например, литий имеет самую низкую плотность среди всех металлов и может плавиться на руках. Натрий и калий могут воспламеняться, когда они выходят взаимодействие с водой. Рубидий, цезий и франций являются самыми реактивными металлами и могут прореагировать с воздухом или водой без всякого внешнего источника огня.
