Галогены, такие как фтор (F), хлор (Cl), бром (Br) и йод (I), относятся к группе элементов, обладающих высокой электроотрицательностью. Это означает, что они имеют большую склонность принимать электроны от других элементов. С другой стороны, щелочные металлы, такие как натрий (Na), калий (K) и литий (Li), имеют низкую электроотрицательность и, следовательно, склонность отдавать электроны.
Ионные связи возникают между галогенами и щелочными металлами, так как галогены стремятся получить один электрон для заполнения своей внешней оболочки, а щелочные металлы готовы отдать один электрон из своей внешней оболочки. При этом галогены образуют анионы, а щелочные металлы образуют катионы. Ионные связи обеспечивают стабильность таких соединений.
Примером ионных связей между галогенами и щелочными металлами является образование хлорида натрия (NaCl). В данном соединении натрий отдает один электрон, образуя катион Na+, а хлор принимает этот электрон, образуя анион Cl-. Частицы Na+ и Cl- притягиваются друг к другу силой ионного притяжения, образуя кристаллическую решетку хлорида натрия.
Ионные связи между галогенами и щелочными металлами являются очень сильными, потому что силы притяжения между катионами и анионами являются электростатическими. Это делает ионные соединения галогенов с щелочными металлами кристаллическими и твердыми соединениями, которые обычно имеют высокие температуры плавления и кипения. Такие соединения имеют широкое применение в различных областях, включая химическую промышленность и медицину.
Галогены и щелочные металлы
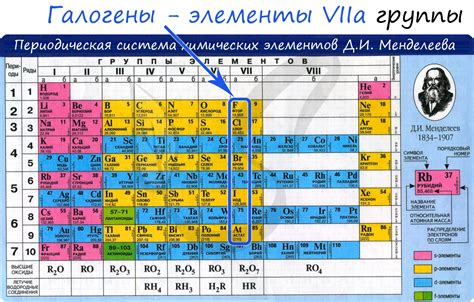
Галогены – это химическая группа элементов, известных своей высокой реактивностью и возможностью образования ионов с отрицательным зарядом. В то время как галогены, такие как фтор, хлор, бром и йод, обладают электроотрицательностью, щелочные металлы, такие как литий, натрий, калий и рубидий, имеют низкую электроотрицательность и образуют ионы с положительным зарядом.
Галогены и щелочные металлы могут образовывать ионные соединения, так как галогены легко отдают электроны и щелочные металлы легко принимают электроны. Это приводит к формированию ионной связи между галогеном и щелочным металлом.
Ионная связь между галогенами и щелочными металлами очень сильная. Как и любая ионная связь, она основывается на притяжении противоположно заряженных ионов. В этом случае, галогенное ион с отрицательным зарядом притягивается к иону щелочного металла с положительным зарядом.
Ионные соединения, образованные галогенами и щелочными металлами, обладают множеством полезных свойств. Например, они могут использоваться в медицине, в производстве материалов и в различных химических реакциях. Кроме того, некоторые ионные соединения галогенов и щелочных металлов применяются в процессе очистки воды и в других сферах промышленности.
Галогены и ионные связи

Галогены (фтор, хлор, бром и иод) являются элементами пятой группы периодической системы. Они обладают высокой электроотрицательностью, что делает их способными совершать ионные связи с щелочными металлами.
Ионная связь - это связь, образующаяся между анионом (отрицательным ионом) и катионом (положительным ионом) благодаря взаимодействию противоположно заряженных частиц. В случае галогенов и щелочных металлов, галогены передают один электрон щелочному металлу, образуя отрицательно заряженные анионы, а щелочные металлы получают этот электрон, образуя положительно заряженные катионы.
Ионная связь между галогенами и щелочными металлами обладает высокой прочностью и жесткостью, что делает их соединения стабильными и нерастворимыми в воде. Это объясняется большой разностью электроотрицательностей галогена и щелочного металла, которая приводит к электростатическому притяжению между анионами и катионами.
Галогены и ионные связи имеют важное применение в различных областях науки и техники. Например, соединение натрия с хлором, известное как поваренная соль, является одним из самых распространенных соединений галогенов и щелочных металлов. Также галогены применяются в производстве химических реагентов, табакокурения, обработки пищевых продуктов и многих других сферах.
Щелочные металлы и ионные связи
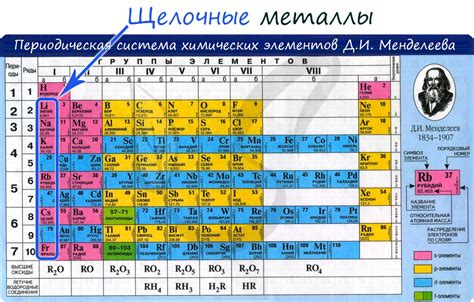
Щелочные металлы, такие как литий, натрий, калий и другие, проявляют высокую реактивность и подвергаются взаимодействию с различными химическими элементами. Одним из способов их связывания является ионная связь.
Ионная связь - это тип химической связи, возникающей между ионами с противоположным зарядом. Щелочные металлы отдают один или несколько электронов и образуют положительные ионы, называемые катионами. Например, натрий отдаёт один электрон и образует ион Na+.
Галогены, такие как фтор, хлор, бром и йод, являются элементами, обладающими высокой электроотрицательностью. За счет своей электромагнитной силы они притягивают электроны и образуют отрицательные ионы, называемые анионами. Например, хлор получает один электрон и образует ион Cl-.
Эти положительные и отрицательные ионы притягиваются друг к другу и образуют ионную связь. Щелочные металлы и галогены обладают уникальными свойствами, поэтому их соединения имеют разнообразные применения в химической промышленности, медицине и других отраслях науки и техники.
Важность галогенов для щелочных металлов

Галогены - это группа химических элементов, включающая фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Они обладают высокой электроотрицательностью и природной склонностью к образованию ионов с отрицательным зарядом.
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., в свою очередь, обладают низкой электроотрицательностью и склонностью к образованию ионов с положительным зарядом. Взаимодействие галогенов с щелочными металлами происходит через ионные связи, что имеет важное значение для обоих классов элементов.
Первое, что делает галогены важными для щелочных металлов, это возможность образования с ними стабильных ионных соединений. Например, хлор может связываться с натрием, образуя хлорид натрия (NaCl) - соль, широко используемую в пищевой промышленности и в быту.
Кроме того, галогены являются важными компонентами в различных химических реакциях, в которых участвуют щелочные металлы. Например, растворение хлорида калия (KCl) в воде приводит к образованию гипохлорита калия (KClO), который широко используется в качестве дезинфицирующего средства.
Кроме своей химической активности, галогены также имеют важное значение в биологии. Бром, например, является необходимым микроэлементом для нормального функционирования щитовидной железы у животных и человека.
Таким образом, галогены играют незаменимую роль для щелочных металлов, обеспечивая образование стабильных ионных соединений и участвуя в различных химических и биологических процессах.
Взаимодействие галогенов и щелочных металлов

Галогены - это химические элементы, принадлежащие к группе VII периодической таблицы. К ним относятся фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Щелочные металлы - это элементы из первой группы периодической таблицы, такие как литий (Li), натрий (Na), калий (K) и др.
Взаимодействие галогенов и щелочных металлов осуществляется через ионные связи. Галогены имеют высокую электроотрицательность, что делает их способными привлекать электроны, которые будут передаваться от металла к галогену. Таким образом, галогены приобретают отрицательный заряд, становясь анионами, а щелочные металлы - положительный заряд, становясь катионами.
В результате такого взаимодействия образуется ионная решетка, в которой щелочные металлы и галогены образуют кристаллы с определенной структурой. Эта структура обеспечивает прочность и стабильность соединения.
Соединения, получаемые при взаимодействии галогенов и щелочных металлов, имеют различные свойства и применения. Например, хлорид натрия (NaCl) - это обычная поваренная соль, широко используемая в пищевой промышленности. Бромид калия (KBr) применяется в фотографии в качестве осветлителя. Фторид натрия (NaF) используется в зубных пастах для профилактики кариеса.
Таким образом, взаимодействие галогенов и щелочных металлов через ионные связи является основой для образования различных соединений с широким спектром применений. Ионные связи обеспечивают стабильность этих соединений и играют важную роль в химических реакциях и процессах, связанных с этими веществами.
Роль галогенов в структуре щелочных металлов

Галогены – это особая группа химических элементов, которые имеют высокую электроотрицательность. Щелочные металлы, в свою очередь, являются представителями первой группы периодической системы элементов и характеризуются низкой электроотрицательностью.
Галогены и щелочные металлы обладают уникальными свойствами, которые позволяют им формировать стабильные ионные связи. Один электрон в внешней оболочке атома галогена и один электрон в валентной оболочке атома щелочного металла создают оптимальные условия для образования ионного соединения.
Особенностью связи между галогенами и щелочными металлами является возможность образования кристаллических решеток. Такие решетки обеспечивают крепкую трехмерную структуру, что делает ионные связи между галогенами и щелочными металлами очень прочными и стабильными.
Благодаря своей высокой электроотрицательности, галогены обладают большой устойчивостью и способностью захватывать электроны у щелочных металлов. Такое взаимодействие способствует образованию ионов с отрицательным зарядом у галогенов и ионов с положительным зарядом у щелочных металлов.
Целью образования ионных связей между галогенами и щелочными металлами является достижение максимальной стабильности и энергетической выгодности системы. Такие связи обладают большой энергией и имеют особое значение в химии и материаловедении.
Химические свойства галогенов и щелочных металлов

Галогены – это группа химических элементов, включающая фтор (F), хлор (Cl), бром (Br) и йод (I). У этих элементов высокая электроотрицательность и неполный электронный октет, что делает их крайне реакционноспособными. Галогены образуют с щелочными металлами ионные связи, образуя соли.
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), обладают низкой электроотрицательностью и полным электронным октетом во внешней оболочке. Они легко отдают электроны и образуют положительно заряженные ионы.
Когда галогены и щелочные металлы вступают в реакцию, галогены захватывают электроны от щелочных металлов, образуя отрицательно заряженные галогенидные ионы, такие как фторид (F-), хлорид (Cl-), бромид (Br-) и йодид (I-). Таким образом, происходит образование ионных соединений – солей галогенов и щелочных металлов.
Галогены играют важную роль в химии и промышленности. Они широко используются в производстве пластмасс, пестицидов, лекарств, отбеливателей и многих других продуктов. Щелочные металлы также имеют широкое применение, особенно натрий и калий, которые являются необходимыми элементами для живых организмов.
Вместе галогены и щелочные металлы образуют важные химические соединения, которые применяются в различных отраслях науки и промышленности. Понимание их химических свойств позволяет разрабатывать новые материалы и технологии, направленные на улучшение жизни людей и охрану окружающей среды.
Физические свойства галогенов и щелочных металлов

Галогены и щелочные металлы - классы элементов, обладающих различными физическими свойствами. Галогены включают фтор, хлор, бром, йод и астат, которые отличаются по цвету, состоянию и температуре плавления. Фтор - светло-желтый газ, хлор - желтовато-зеленый газ, бром - красный жидкий элемент, йод - темно-фиолетовые кристаллы, астат - чёрные кристаллы.
Щелочные металлы, к которым относятся литий, натрий, калий, рубидий, цезий и франций, имеют отличные физические свойства. Эти элементы являются мягкими и хорошо проводят тепло и электричество. Они имеют низкую температуру плавления и высокую точку кипения.
Галогены и щелочные металлы образуют ионные соединения, при которых галогены отдают свои внешние электроны щелочным металлам, образуя отрицательно заряженные ионы галогена и положительно заряженные ионы щелочного металла. Их соединения обладают высокой степенью растворимости в воде и образуют кристаллы с характерными структурами и физическими свойствами.
В заключении можно сказать, что галогены и щелочные металлы обладают уникальными физическими свойствами, которые делают их незаменимыми во многих процессах и приложениях. Понимание этих свойств позволяет управлять химическими реакциями и использовать эти элементы в различных областях науки и промышленности.
Химические реакции галогенов и щелочных металлов
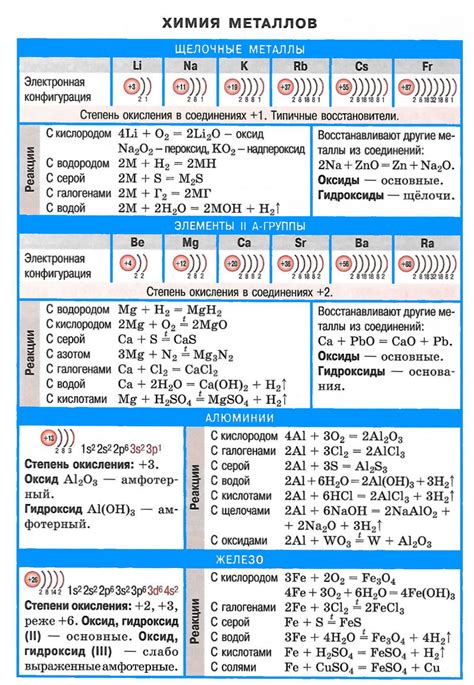
Галогены (фтор, хлор, бром, йод) и щелочные металлы (литий, натрий, калий) являются элементами, которые легко образуют химические соединения друг с другом. Взаимодействие галогенов с щелочными металлами основано на образовании ионных связей.
Когда галоген вступает в контакт с щелочным металлом, происходит отщепление электрона от металла и образование аниона галогена. Таким образом, галоген приобретает отрицательный заряд, а щелочный металл - положительный заряд. Заряды притягиваются и формируют ионную связь.
Взаимодействие галогенов с щелочными металлами протекает с выделением большого количества тепла и света. Это свойство можно использовать при проведении пиротехнических шоу или воспламенении галогенных ламп.
Реакции галогенов и щелочных металлов могут протекать как в газовой фазе, так и в растворе. В газовой фазе образовавшееся ионное соединение представляет собой кристаллическую структуру, в которой положительно заряженные щелочные металлы и отрицательно заряженные галогены образуют регулярную решетку.
Практическое применение галогенов и щелочных металлов

Галогены (фтор, хлор, бром, иод) и щелочные металлы (литий, натрий, калий, рубидий, цезий) являются важными элементами в различных областях практического применения. Они обладают уникальными свойствами и находят широкое применение в химической промышленности, электронике, медицине и других сферах.
Галогены имеют высокую реакционную способность и отличаются широким диапазоном применения. Фтор применяется в производстве химических соединений, пластиков, электронных компонентов и ароматических соединений. Хлор используется в производстве пластиков, резиновых изделий, дезинфекции воды и других химических процессах. Бром находит применение в противоогневых системах, фотографии и медицине. Иод используется в производстве лекарственных препаратов, пищевой промышленности и ядерной медицине.
Щелочные металлы также имеют множество применений. Литий используется в производстве аккумуляторов, электроники, лекарственных препаратов и керамики. Натрий применяется в производстве стекла, щелочи, пищевых добавок и металлов. Калий находит применение в сельском хозяйстве, производстве удобрений и пищевой промышленности. Рубидий используется в исследованиях физики и светолечении. Цезий находит применение в научных исследованиях, а также в геофизике и оптике.
В целом, галогены и щелочные металлы играют важную роль в различных отраслях промышленности и научных исследованиях. Их уникальные свойства позволяют создавать новые материалы, улучшать электронные устройства, разрабатывать новые лекарственные препараты и проводить различные химические процессы. Практическое применение галогенов и щелочных металлов продолжает расширяться, внося важный вклад в современные технологии и науку.
Вопрос-ответ

Зачем галогены связываются с щелочными металлами через ионные связи?
Галогены связываются с щелочными металлами через ионные связи, потому что такое взаимодействие позволяет достичь электронной устойчивости обоим атомам, образуя ионы с положительной и отрицательной зарядами. Это позволяет образовывать стабильные ионные соединения.
Какие галогены могут связываться с щелочными металлами через ионные связи?
В основном галогены, такие как фтор, хлор, бром и йод, связываются с щелочными металлами через ионные связи. Это связано с их электронной конфигурацией и способностью давать отрицательные ионы при взаимодействии с щелочными металлами.
Как выглядит ионная связь между галогеном и щелочным металлом?
Ионная связь между галогеном и щелочным металлом представляет собой взаимодействие между положительно заряженным ионом щелочного металла (например, натрия) и отрицательно заряженным ионом галогена (например, хлора). В результате образуется структура, в которой ионы располагаются в трехмерной решетке, привлекаясь друг к другу электростатическими силами.
