Щелочные металлы - это элементы, которые принадлежат к первой группе периодической таблицы: литий, натрий, калий, рубидий, цезий и франций. Они характеризуются высокой реактивностью и растворимостью в воде. Из-за своих свойств они часто образуют соединения с различными элементами, включая газы.
Литий, первый элемент группы, обладает наименьшей реактивностью среди всех щелочных металлов. Он образует газообразные соединения в основном с элементами, которые имеют низкую энергию ионизации, такими как кислород и азот. Натрий, калий, рубидий и цезий, более реактивные, образуют газы с большим количеством элементов, включая галогены, аммиак и сероводород.
Газообразные соединения щелочных металлов обладают различными свойствами и находят применение в разных областях. Например, газообразный аммиак, получаемый из реакции калия и азотной кислоты, используется в производстве удобрений и азотных газов. Газообразные галогены, образованные с щелочными металлами, часто используются в процессах оксидации и хлорирования различных соединений.
Важно отметить, что газообразные соединения щелочных металлов могут быть чрезвычайно опасными. Они могут быть ядовитыми, взрывоопасными или коррозионно-активными. При работе с такими соединениями необходимо соблюдать особые условия безопасности.
Таким образом, щелочные металлы способны образовывать различные газы с помощью реакций с другими элементами. Эти газы используются в различных промышленных процессах и научных исследованиях, однако требуют особой осторожности в обращении.
Щелочные металлы
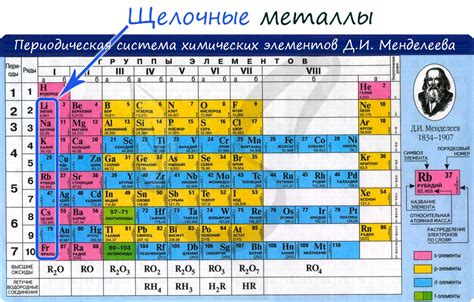
Щелочные металлы - это элементы периодической системы, которые относятся к первой группе: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой реактивностью и способностью образовывать газы.
Когда щелочные металлы взаимодействуют с водой, они образуют гидроксид и выделяются водородные газы. Например, литий реагирует с водой, образуя гидроксид лития и выделяя водородный газ:
2Li + 2H2O -> 2LiOH + H2↑
Натрий, калий и другие щелочные металлы также проявляют подобную реакцию, образуя соответствующие гидроксиды и выделяя водород. Это делает их полезными для различных промышленных и научных процессов.
Кроме того, щелочные металлы могут образовывать газы при взаимодействии с кислородом. Например, при нагревании натрия в атмосфере кислорода образуется оксид натрия и выделяется кислородный газ:
4Na + O2 -> 2Na2O
2Na2O + O2 -> 4Na2O2
Также щелочные металлы могут образовывать газы при взаимодействии с другими химическими соединениями и элементами. Например, натрий может образовывать газообразные хлориды при реакции с хлором:
2Na + Cl2 -> 2NaCl
В результате таких реакций могут образовываться различные газы, которые имеют свои свойства и применения в научных, промышленных и других сферах деятельности.
Особенности и свойства щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и др., обладают рядом уникальных свойств, которые делают их особенными в химических реакциях и взаимодействиях с другими веществами.
1. Высокая реакционная способность: Одной из главных особенностей щелочных металлов является их высокая реакционная способность. Они легко взаимодействуют с окислителями, какими бы они ни были, и образуют газы. Это связано с низкой ионизационной энергией щелочных металлов, что делает их электроны легкими объектами для отдачи.
2. Образование газов: Щелочные металлы могут образовывать разнообразные газы при взаимодействии с водой, кислородом или другими веществами. Например, литий реагирует с водой, образуя гидроксид лития и водородный газ, натрий реагирует с кислородом и образует оксид натрия и кислород, калий реагирует с хлором и образует хлорид калия и хлор. Это лишь некоторые из возможных реакций щелочных металлов.
3. Агрессивность: Щелочные металлы обладают очень высокой агрессивностью и опасными свойствами. Они могут вызывать ожоги при контакте с кожей и слизистыми оболочками. К тому же, легко воспламеняются на воздухе и реагируют с большинством веществ, включая воду, что делает их использование небезопасным без должной осторожности и мер предосторожности.
4. Низкая плотность: Щелочные металлы обладают низкой плотностью, что делает их легкими и подвижными. Они вплавляются на воздухе, и плавящаяся масса образует каплю, а на поверхности образуется пленка окислов. Из-за этой свойства щелочные металлы удобны для использования в таких областях, как аккумуляторы или производство сплавов.
В целом, свойства щелочных металлов делают их важными элементами в различных областях промышленности и науки, однако необходимо быть осторожными во время обращения с ними, учитывая их опасность и реакционную способность.
Взаимодействие щелочных металлов с водой

Щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), обладают способностью реагировать с водой. Это происходит из-за их высокой реакционной способности и низкой ионизационной энергии. В результате такого взаимодействия, газы, водород (H2) и щелочногидрид металла (MH), образуются.
Реакция щелочных металлов с водой протекает очень бурно и с выделением большого количества тепла. При этом металлы входят во взаимодействие с молекулами воды, образуя гидроксид металла (M(OH)2) и выделяя водород. Гидроксид металла обычно образует амфотерный раствор, который можно использовать в различных химических реакциях и промышленности.
Реакция щелочных металлов с водой имеет эффектный внешний вид. Металл активно плавает в воде, выделяя множество маленьких пузырьков газа водорода. При этом изначально чистая и прозрачная вода превращается в мутную и молочно-белую суспензию из гидроксида металла. Взаимодействие щелочных металлов с водой необходимо производить с осторожностью, так как может возникнуть взрывоопасная ситуация, особенно при работе с большими количествами вещества.
Образование газов
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, могут образовывать различные газы при взаимодействии с другими веществами. Эти металлы обладают большой химической активностью, поэтому легко реагируют с кислородом, водой и различными кислотами, образуя газы.
При взаимодействии щелочных металлов с кислородом образуется оксид металла. Например, при сжигании лития образуется оксид лития, который является твердым веществом. Взаимодействие натрия с кислородом приводит к образованию оксида натрия, который также является твердым веществом.
При контакте щелочных металлов с водой происходит образование водорода. Например, литий реагирует с водой, образуя гидроксид лития и водород. Калий также реагирует с водой, образуя гидроксид калия и водород. Взаимодействие натрия с водой приводит к образованию гидроксида натрия и водорода. При этом реакция происходит с выделением большого количества тепла.
Щелочные металлы также могут образовывать газы при взаимодействии с кислотами. Например, реакция натрия с соляной кислотой приводит к образованию хлорида натрия и выделению хлороводородного газа. Реакция калия с серной кислотой образует сульфат калия и выделяет сернистый ангидрид.
Таким образом, щелочные металлы способны образовывать различные газы при реакциях с кислородом, водой и кислотами. Эти реакции являются химическими и сопровождаются изменением состояния вещества и выделением энергии или газов.
Химические реакции

Химические реакции являются основой всех процессов, происходящих в природе. Они представляют собой превращение одних веществ в другие под воздействием различных факторов, таких как температура, давление, концентрация и катализаторы. Химические реакции могут быть различного типа: синтез, анализ, замещение, окисление и восстановление.
Щелочные металлы, такие как натрий, калий и литий, могут образовывать газы в химических реакциях. Например, при взаимодействии щелочного металла с водой происходит образование водорода. Эта реакция представляет собой окислительно-восстановительный процесс, при котором щелочный металл окисляется, а вода восстанавливается.
Кроме того, щелочные металлы могут образовывать газы при взаимодействии с кислородом. Например, при горении щелочного металла в присутствии кислорода образуется оксид металла и выделяется углекислый газ. Эта реакция происходит с выделением большого количества тепла и света.
Щелочные металлы также могут образовывать газы при реакции с другими веществами, такими как кислоты или галогены. Например, при реакции натрия с хлором образуется хлорид натрия и выделяется хлор. Эта реакция является одной из основных реакций в промышленности для получения хлора и его соединений.
Таким образом, щелочные металлы могут образовывать различные газы в химических реакциях, что делает их важными и полезными веществами в промышленности и научных исследованиях.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, широко применяются в различных отраслях промышленности благодаря своим уникальным свойствам.
Одно из главных применений щелочных металлов - производство щелочей. Щелочи нашли свое применение во многих отраслях, включая химическую, фармацевтическую и пищевую промышленность. Они используются для регулирования pH-уровня, очистки воды, экстрагирования растительных масел и многих других процессов.
Еще одно важное применение щелочных металлов - при производстве стекла. Оксиды щелочных металлов, такие как оксид натрия, являются основными компонентами стекла. Эти металлы придают стеклу технические свойства, такие как прозрачность, твердость и устойчивость к коррозии.
Щелочные металлы также используются в батареях и аккумуляторах. В основном для этой цели применяется литий. Литиевые батареи широко используются в электронике, мобильных устройствах, электромобилях и даже в солнечных батареях. Литий-ионные аккумуляторы обладают высокой энергоемкостью и длительным сроком службы.
Калий и натрий также находят применение в производстве удобрений. Калийные и натриевые соединения используются в качестве источников питательных веществ для растений. Эти удобрения повышают урожайность и качество сельскохозяйственных культур.
Таким образом, щелочные металлы играют важную роль в различных отраслях промышленности. Их уникальные свойства и химические реакции позволяют использовать их для решения различных задач и процессов, благотворно влияя на развитие технологий и повышение эффективности производства.
Особенности в использовании
Щелочные металлы, такие как литий, натрий и калий, могут образовывать газы при взаимодействии с водой или кислородом. Это свойство их делает полезными в различных промышленных процессах и научных исследованиях.
Однако, при использовании щелочных металлов необходимо соблюдать особые меры предосторожности. Взаимодействие с водой может привести к образованию гидроксидов и выделению водорода, что может быть опасным из-за возможности его возгорания. Поэтому необходимо обрабатывать щелочные металлы в специальных условиях, с использованием защитных средств и под удалённым наблюдением.
Кроме того, образование газов может привести к реакциям с окружающей средой, что может вызвать нежелательные последствия. Поэтому при работе с щелочными металлами необходимо учитывать окружающую среду и предпринимать соответствующие меры для предотвращения утечек газов и их последствий.
Также стоит отметить, что газы, образующиеся при взаимодействии щелочных металлов, могут использоваться в различных отраслях промышленности. Например, водород получают из взаимодействия лития с водой и используют его как источник энергии в топливных элементах. Натрий и калий также применяются в химической промышленности и в пищевой промышленности.
Вопрос-ответ

Какие газы образуют щелочные металлы?
Щелочные металлы, такие как литий, натрий, калий и т. д., могут образовывать различные газы в зависимости от условий. Например, они могут образовывать водород при реакции с водой. Кроме того, они могут образовывать аммиак при реакции с аммиачной солью. В некоторых случаях они могут образовывать оксиды, такие как оксид натрия или оксид калия.
Каким образом щелочные металлы образуют газы?
Щелочные металлы образуют газы в результате их реакции с различными веществами. Например, когда щелочный металл вступает в контакт с водой, происходит реакция, в результате которой образуется газ, такой как водород. Эта реакция называется гидролизом. Также, щелочные металлы могут реагировать с аммиачной солью, образуя аммиак в газообразном состоянии. Образование газа при реакции щелочных металлов с определенными веществами зависит от их химического состава и свойств.
Какие газообразные соединения могут быть образованы при взаимодействии щелочных металлов?
Щелочные металлы, такие как литий, натрий, калий и др., могут образовывать различные газообразные соединения при реакции с различными веществами. Например, при взаимодействии с водой они образуют водород. При реакции с аммиачной солью может образовываться аммиак. Также, щелочные металлы могут образовывать оксиды, такие как оксид натрия или оксид калия. Финальное газообразное соединение, образующееся при взаимодействии щелочных металлов, зависит от условий реакции и свойств веществ, с которыми они реагируют.
