Щелочные металлы – это группа элементов, которые имеют много общих химических и физических свойств. Они включают в себя такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают высокой реактивностью и хорошей проводимостью электричества и тепла.
Щелочные металлы являются самыми активными металлами в периодической таблице. Они легко реагируют с кислородом, водой и многими другими веществами. Химическое свойство, которое отличает щелочные металлы, это их способность образовывать ионы со зарядом +1. Именно эта способность делает их такими реактивными.
Щелочные металлы широко используются в различных отраслях науки и промышленности. Например, они используются в производстве аккумуляторов, стекла, серебряного зеркала и многих других материалов. Кроме того, щелочные металлы играют важную роль в биологических процессах организмов и могут быть использованы в медицине для лечения различных заболеваний.
Свойства щелочных металлов для 9 класса

Щелочные металлы - это химические элементы, которые относятся к первой группе периодической таблицы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих элементов есть ряд общих свойств, которые помогают их классифицировать.
Первое свойство щелочных металлов - это то, что они очень реактивны. Они с легкостью вступают в химические реакции с другими веществами. Например, они реагируют с водой, образуя щелочной гидроксид и выделяя водород. Это свойство делает их полезными для многих промышленных процессов.
Второе свойство щелочных металлов - это то, что они имеют низкую плотность. Они являются легкими элементами, что делает их удобными для использования в космической технике. Например, литий используется в изготовлении лёгких батарей для электронных устройств.
Третье свойство щелочных металлов - это то, что они имеют низкую температуру плавления. В условиях комнатной температуры они находятся в жидком состоянии. Они также имеют низкую температуру кипения, поэтому они могут использоваться для охлаждения электрических устройств.
Щелочные металлы обладают характерным цветом пламени при горении. Например, литий горит красным пламенем, натрий - желтым, калий - фиолетовым. Это свойство позволяет легко идентифицировать эти металлы по их горению.
Из-за своей высокой реактивности, щелочные металлы хранятся в специальных контейнерах с инертным газом или специальной среде, чтобы избежать взаимодействия с воздухом или влагой. Они также используются в различных промышленных и научных областях, включая производство стекла, фармацевтическую промышленность и производство удобрений.
Химические свойства щелочных металлов

Щелочные металлы - это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. У них есть ряд характерных химических свойств.
Во-первых, щелочные металлы очень реактивны. Они быстро и легко реагируют с водой, кислородом и многими другими веществами. Реакция с водой приводит к выделению водорода и образованию щелочных растворов. Также они образуют стабильные оксиды и пероксиды.
Во-вторых, щелочные металлы обладают высокой активностью в химических реакциях. Они легко отдают свои электроны, поэтому являются сильными восстановителями. За счет этого свойства они могут превращаться в ионы и образовывать растворимые соли.
В-третьих, щелочные металлы имеют низкую плотность и низкую точку плавления. Например, литий - легкий и мягкий металл с плотностью меньше воды, что делает его плавучим. Отличительной чертой щелочных металлов также является реакция с кислородом, которая приводит к образованию оксидов и пероксидов с ярко выраженными цветами.
В целом, химические свойства щелочных металлов связаны с их низкой электроотрицательностью и высокой реактивностью. Они широко используются в различных промышленных и научных областях, включая производство лекарств, стекла, пищевых продуктов и других материалов.
Физические свойства щелочных металлов

Щелочные металлы - это химические элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. У них есть несколько физических свойств, которые характерны именно для этой группы металлов.
Плотность: Щелочные металлы обладают низкой плотностью, что делает их легкими и подвижными. Наиболее легким из них является литий, а наиболее тяжелым - цезий.
Плавление и кипение: Щелочные металлы имеют низкую температуру плавления и кипения, что означает, что они легко переходят из твердого состояния в жидкое и обратно. Например, калий плавится при температуре всего около 63 градусов Цельсия.
Проводимость: Щелочные металлы являются хорошими проводниками электричества. У них высокая электропроводность, что делает их полезными в различных электронных устройствах.
Пластичность: Щелочные металлы обладают высокой пластичностью - они могут легко деформироваться без разрушения. Это свойство делает их полезными для различных металлических изделий и конструкций.
Реакция с водой: Щелочные металлы очень активно реагируют с водой, образуя щелочные гидроксиды и высвобождая водород. Это свойство делает их опасными при контакте с водой или влажными веществами.
Цветность: Щелочные металлы имеют характерные цвета, которые могут использоваться для их идентификации. Например, литий имеет серебристо-белый цвет, а калий - серый или серебристый.
Применение щелочных металлов в промышленности и науке
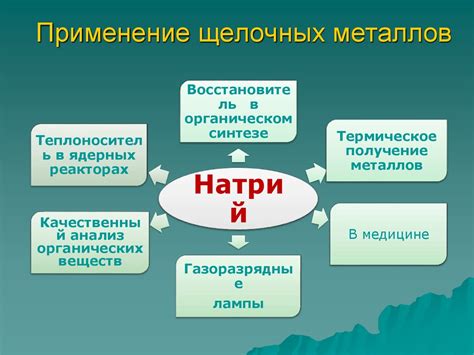
Щелочные металлы - это группа химических элементов, включающая литий, натрий, калий, рубидий и цезий. Они широко используются в промышленности и науке благодаря своим уникальным свойствам.
В промышленности щелочные металлы применяются в различных отраслях, например, в производстве стекла. Калий используется в производстве удобрений, а также в производстве щелочей и мыла. Натрий используется в производстве стекла, щелочей, мыла и многих других химических соединений. Литий используется в производстве аккумуляторов, стекла и лекарственных препаратов.
В науке щелочные металлы играют важную роль. Например, литий используется в качестве катализатора в различных химических реакциях. Натрий и калий используются в экспериментах по исследованию электрохимических свойств веществ. Щелочные металлы также используются в качестве средств для хранения и переноса энергии.
Одним из самых интересных применений щелочных металлов является их использование в светоизлучающих диодах (LED-диодах). Натрий и калий используются в процессе производства LED-диодов, что позволяет им обеспечивать яркое и энергоэффективное освещение.
Таким образом, щелочные металлы находят широкое применение в промышленности и науке, благодаря своим уникальным химическим свойствам и возможностям. Их использование способствует развитию различных технологий и научных исследований.
Опасность использования щелочных металлов

Щелочные металлы – это группа элементов, которые обладают высокой реактивностью и обилием химических реакций. Они включают литий, натрий, калий, рубидий, цезий и франций.
Однако, несмотря на их широкое применение и полезные свойства, использование щелочных металлов может быть опасным.
Во-первых, щелочные металлы обладают высокой реактивностью, что делает их легко воспламеняемыми. Даже контакт с воздухом может вызвать их воспламенение, что приводит к серьезным пожарам.
Во-вторых, они также реагируют с водой, образуя очень щелочные растворы. При этом может выделяться водород, который является легко воспламеняемым газом. Это может вызвать взрывы и ожоги.
Кроме того, контакт с щелочными металлами может вызвать раздражение кожи и дыхательных путей. При попадании в глаза они могут вызвать серьезные ожоги и повреждения зрения.
Поэтому, при использовании щелочных металлов, необходимо соблюдать все меры предосторожности и работать в специально оборудованных помещениях с применением персональной защиты. Также необходимо хранить их в специальных контейнерах, чтобы избежать возможных аварийных ситуаций.
Вопрос-ответ

Какие элементы относятся к щелочным металлам?
В щелочные металлы входят литий, натрий, калий, рубидий, цезий и франций.
Для чего используются щелочные металлы?
Щелочные металлы имеют широкое применение в различных областях. Например, натрий используется в производстве стекла, а калий - в сельском хозяйстве. Литий находит применение в аккумуляторах, а цезий используется для научных и медицинских исследований.
