Щелочные металлы - это элементы группы I периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они получили свое название из-за своей реактивности и способности образовывать щелочные растворы. Щелочные металлы обладают уникальными свойствами и широко используются в различных областях, от металлургии до электроники.
Тип химической связи, которую образуют щелочные металлы, является ионной. В ионной связи происходит передача электронов от одного атома к другому, образуя положительно и отрицательно заряженные ионы. В случае щелочных металлов, электрон внешней оболочки переходит от металла к неметаллу, что приводит к образованию положительно заряженных ионов щелочного металла и отрицательно заряженных ионов соответствующего неметалла.
Основные особенности щелочных металлов заключаются в их низкой плотности, низкой температуре плавления и кипения, а также в их реактивности и способности образовывать щелочные растворы. Благодаря этим свойствам, щелочные металлы используются в производстве сплавов, катализаторов и химических реактивов. Они также являются важными компонентами батарей и ядерных реакторов, а также используются в фототехнике и оптике.
Кроме того, щелочные металлы обладают высокой электропроводностью и мягкостью. Это позволяет им использоваться в электронике, включая создание проводников электричества и изготовление экранных покрытий. Щелочные металлы также имеют важное применение в медицине и фармацевтической промышленности, где они используются в качестве лечебных препаратов, реагентов и катализаторов.
Химическая связь в щелочных металлах: особенности и типы

Щелочные металлы – это группа элементов, включающая литий, натрий, калий, рубидий, цезий и франций. У этих металлов общая особенность – они относятся к периоду I и группе 1 в периодической системе.
В щелочных металлах преобладает ионная химическая связь. Ионы щелочных металлов имеют положительный заряд, так как они способны отдавать свои валентные электроны. Ионы образуют кристаллическую решетку, в которой каждый катион окружен шестью анионами.
Щелочные металлы обладают высокой химической активностью, что обусловлено слабостью ионной связи, а также большим радиусом атома. Из-за этого они реагируют с водой, кислородом и другими веществами. Реакции щелочных металлов с веществами происходят с выделением большого количества тепла и образованием гидроксидов.
Важно отметить, что щелочные металлы обладают низкой плотностью, низкой температурой плавления и кипения, а также хорошей электропроводностью. Они широко используются в различных областях, таких как производство щелочей, органического синтеза, производства стекла и других материалов.
Определение и общая информация

Щелочные металлы - это элементы, которые находятся в первой группе периодической таблицы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Щелочные металлы относятся к одной из двух основных категорий элементов - активным металлам. Они характеризуются низкой плотностью, мягкостью и низкой температурой плавления и кипения. В природе они обычно встречаются в соединенном виде, так как очень реактивны и легко прореагировать с водой и кислородом.
Щелочные металлы образуют ионные соединения с отрицательно заряженными атомами. У них хорошо выраженные металлические свойства, такие как хорошая электропроводность и блеск. Эти металлы имеют низкую электроотрицательность и склонность к отдаванию одного электрона, образуя положительно заряженные ионы.
Из-за своей высокой реактивности, щелочные металлы имеют множество практических применений. Они используются в производстве батареек, сплавов, катализаторов и в других химических процессах. Некоторые щелочные металлы, такие как литий, также используются в фармацевтической и медицинской отраслях.
Атомы и молекулы щелочных металлов
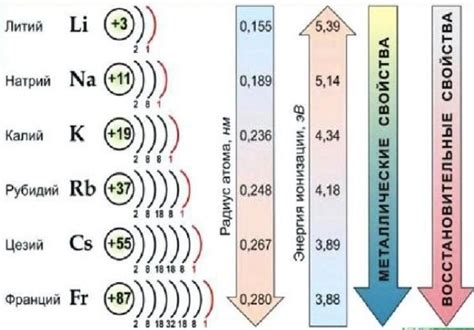
Щелочные металлы - это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У всех щелочных металлов общая черта - одна валентная электронная оболочка, на которой находится один электрон.
Атомы щелочных металлов имеют достаточно больший радиус в сравнении с другими элементами, что обусловлено слабой электростатической силой притяжения ядра к внешнему электрону. Это делает эти элементы очень реакционноспособными и более склонными к образованию связей с другими элементами.
Щелочные металлы могут образовывать ионные связи с неметаллами, так как они готовы отдать свой внешний электрон и образовать положительный ион. В результате образуется соединение, где ион щелочного металла притягивается к иону неметалла с противоположным зарядом. Например, когда натрий (Na) реагирует с хлором (Cl), образуется ион Na+ и ион Cl-, которые, благодаря силе электростатического притяжения, образуют ионное соединение натрия и хлора - хлорид натрия (NaCl).
Молекулы щелочных металлов также могут образовывать связи с другими молекулами, например, взаимодействуя с молекулами воды. В результате образуются вещества, называемые гидроксидами щелочных металлов. Например, реакция натрия с водой приводит к образованию гидроксида натрия (NaOH) и выделению водорода (H2).
Исключением среди щелочных металлов является литий, который, благодаря меньшему радиусу своего атома и более сильной электростатической силе, может образовывать также молекулы, содержащие ковалентные связи. Например, литий может образовывать молекулы с атомами галогенов, такие как фтор (F) или хлор (Cl), образуя координатные ковалентные связи.
Ионная связь в щелочных металлах

Щелочные металлы представляют собой химические элементы первой группы периодической системы, включая литий, натрий, калий, рубидий, цезий и франций. Они отличаются особыми свойствами, такими как низкая электроотрицательность, высокая реакционоспособность и способность образовывать ионные связи.
Ионная связь в щелочных металлах основана на электростатическом притяжении между положительно заряженными ионами металла и отрицательно заряженными ионами неметалла. Щелочные металлы имеют только один электрон в внешней энергетической оболочке, что делает их склонными отдать это электрон и образовать положительные ионы.
После потери электрона, щелочные металлы приобретают положительный заряд и превращаются в катионы. С другой стороны, неметаллы, такие как кислород, сера и галогены, имеют большую электроотрицательность и имеют тенденцию принять электрон, образуя отрицательные ионы – анионы.
Притяжение между положительными иоными щелочных металлов и отрицательными ионами неметаллов формирует ионную связь. Эта связь характеризуется высокой энергией связи и образованием решетки ионов, где каждый ион окружен противоположно заряженными ионами.
Ионная связь в щелочных металлах обусловливает их свойства, такие как хорошая проводимость электричества и тепла, высокая растворимость в воде и реакционная способность с различными веществами. Особенности ионной связи делают щелочные металлы важными компонентами в различных химических и технических процессах.
Металлическая связь в щелочных металлах

Металлическая связь представляет собой тип химической связи, характерный для металлических элементов, включая щелочные металлы. Она основывается на взаимодействии свободных электронов в валентной оболочке металла с положительно заряженными ионами, образуя так называемую "электронную облако".
В случае щелочных металлов, таких как литий, натрий, калий и другие, металлическая связь проявляется особенно ярко. Валентные электроны в этих элементах легко отдаются, что приводит к образованию положительно заряженных ионов металла и свободных электронов.
Основными характеристиками металлической связи в щелочных металлах являются высокая электропроводность и теплопроводность. Это связано с наличием свободно движущихся электронов, которые способны передавать энергию и заряды через вещество.
Кроме того, металлическая связь обеспечивает хорошую пластичность и формоизменяемость щелочных металлов. Электронная оболочка, состоящая из свободных электронов, позволяет атомам металла совершать относительно свободные движения, что способствует хорошей деформируемости материала.
Таким образом, металлическая связь играет ключевую роль в определении физических и химических свойств щелочных металлов. Она обуславливает их металлические свойства, делая их важной группой элементов в химии и промышленности.
Ковалентная связь в щелочных металлах
Щелочные металлы, такие как литий, натрий, калий и др., обладают особым типом химической связи - ковалентной связью. Ковалентная связь формируется путем обмена электронами между атомами металла и атомами другого элемента. Это приводит к образованию молекулы, состоящей из атомов обоих элементов.
В щелочных металлах каждый атом образует одну или несколько ковалентных связей с атомами других элементов. Это обуславливает прочное соединение металла с другими веществами и высокие температуры плавления и кипения щелочных металлов.
При образовании ковалентной связи в щелочных металлах происходит перекрытие электронных облаков атомов. При этом электроны, находящиеся в валентной оболочке металла, переходят на уровень энергии более высокого атома. Это позволяет металлу стабилизировать свою электронную конфигурацию и образовать более прочное соединение.
Ковалентная связь в щелочных металлах также обладает свойствами делимости и растяжимости. Это означает, что их структура может быть разрушена или изменена без полного разрыва связей между атомами. Это приводит к образованию ионов и растворению веществ, содержащих щелочные металлы, в воде или других растворителях.
Физические свойства щелочных металлов

Щелочные металлы – это группа металлов, включающая литий, натрий, калий, рубидий, цезий и франций. Они обладают рядом характерных физических свойств, которые делают их уникальными в химическом мире.
Мягкость и низкая плотность – одно из основных физических свойств щелочных металлов. Они являются самыми мягкими металлами из всех существующих в таблице периодических элементов. Кроме того, у них очень низкая плотность, что делает их легкими и такими воздушными.
Пластичность и тугоплавкость – другие важные физические свойства щелочных металлов. Они хорошо обрабатываются и могут быть легко изготовлены в различные формы. Однако, при повышении температуры, они становятся тугоплавкими и могут приобрести вяжущие свойства.
Электропроводность – щелочные металлы обладают высокой электропроводностью, что делает их полезными в различных электротехнических приложениях. Некоторые щелочные металлы, такие как натрий и калий, даже взрываются при контакте с водой из-за быстрого выделения водорода и высокой реактивности.
Цвет и блеск – щелочные металлы имеют яркий цвет и блеск, что делает их привлекательными с точки зрения дизайна и эстетики. Они обычно имеют серебристо-серые оттенки, но могут изменять свой цвет в зависимости от окружающих условий и наличия других элементов.
Химические реакции щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, представляют собой группу элементов, которые легко вступают в химические реакции из-за высокой активности своих внешних электронных оболочек. Благодаря этому щелочные металлы обладают ярко выраженным металлическим характером.
Одной из основных химических реакций щелочных металлов является реакция с водой. Они реагируют с водой, освобождая водород и образуя щелочную соль. Эта реакция происходит энергично и с выделением тепла. Например, натрий реагирует с водой по следующему уравнению: 2Na + 2H2O → 2NaOH + H2. При этом образуется щелочное гидроксидное соединение и водород, который может воспламеняться.
Еще одной характерной реакцией щелочных металлов является реакция с кислородом. Они сгорают в воздухе при нагревании, образуя оксиды. Например, при сгорании лития образуется литиевый оксид: 4Li + O2 → 2Li2O. Эти оксиды являются щелочными и растворяются в воде, образуя щелочные гидроксиды.
Щелочные металлы также реагируют с кислотами, образуя соль и выделяя водород. Например, натрий реагирует с соляной кислотой по следующему уравнению: 2Na + 2HCl → 2NaCl + H2. Такие реакции протекают быстро и энергично.
Стоит отметить, что щелочные металлы обладают способностью реагировать с некоторыми неметаллами, например, с халогенами, образуя соответствующие соли. Например, реакция натрия с хлором приводит к образованию хлорида натрия: 2Na + Cl2 → 2NaCl.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это элементы химической группы 1 периодической системы, которые имеют наиболее низкую ионизационную энергию и образуют ионы с положительным зарядом. Основными представителями щелочных металлов являются литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какая связь образуется между атомами щелочных металлов?
Между атомами щелочных металлов образуется ионическая связь. В этом типе связи один атом отдает один или несколько электронов другому атому, образуя ионы с противоположным зарядом. Таким образом, атомы щелочных металлов становятся ионами с положительным зарядом, а атомы, получающие электроны, становятся ионами с отрицательным зарядом.
Какие особенности имеют щелочные металлы?
У щелочных металлов есть несколько особенностей. Во-первых, они имеют низкую плотность, что делает их легкими и мягкими металлами. Во-вторых, они очень реактивны и быстро окисляются воздухом и водой. В-третьих, они имеют низкую температуру плавления и кипения. И наконец, они обладают большой электропроводностью и используются в различных электронных устройствах и батареях.
Где можно обнаружить щелочные металлы в природе?
Щелочные металлы в природе обнаруживаются в виде минералов, таких как галиды, карбонаты и сульфаты. Основные источники щелочных металлов - это соленые озера, солевые руды, почвы и морская вода. Они также могут находиться в некоторых растениях и животных, таких как морские водоросли и рыбы.
