Щелочные металлы – это группа элементов, которые находятся в первой группе периодической таблицы Менделеева. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы являются самыми активными металлами в периодической системе и обладают рядом уникальных свойств.
Одним из главных свойств щелочных металлов является низкая плотность, что делает их легкими и хорошо плавящимися. Они также обладают высокой реактивностью, легко реагируя с водой или кислородом. Кроме того, щелочные металлы обладают низкой температурой плавления и кипения.
Щелочные металлы имеют широкое применение в различных областях. Например, литий широко используется в производстве аккумуляторов, создании алюминиевых сплавов и в производстве лекарств. Натрий используется в производстве стекла и щелочи, а также в пищевой промышленности. Калий находит применение в удобрениях и в производстве мыла. Рубидий, цезий и франций, хотя и имеют ограниченное применение, могут быть использованы в часах и лазерах.
Щелочные металлы и их химические свойства
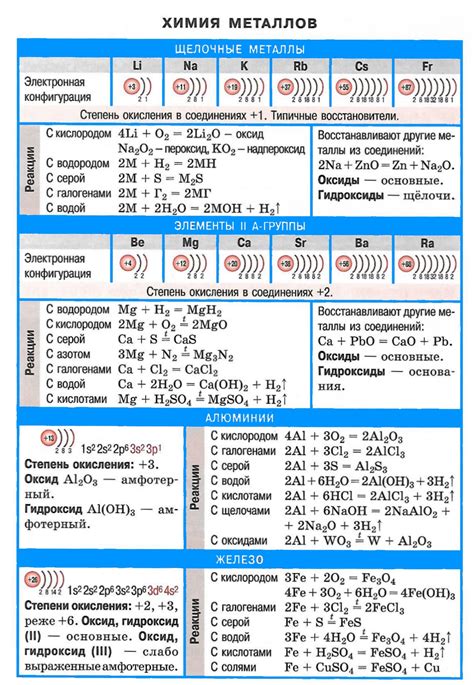
Щелочные металлы - это группа элементов периодической системы, которые входят в первую группу. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы являются мягкими и реактивными металлами.
У щелочных металлов есть ряд уникальных химических свойств. Например, они все являются крайне реактивными и легко вступают в реакцию с водой, кислотами и другими веществами. Однако, сильно отличаются эти металлы по своей химической активности, а также по своей плотности и температуре плавления.
Литий, самый легкий из щелочных металлов, обладает наименьшей плотностью и температурой плавления. Он используется в литий-ионных аккумуляторах, а также применяется в производстве стекла и керамики.
Натрий является важным элементом в пищевой промышленности и используется для приготовления пищевых добавок и солей. Он также широко применяется в производстве щелочей, бумаги и мыла.
Калий играет важную роль в растениях и используется в сельском хозяйстве в качестве удобрения. Калийные соединения также находят применение в производстве стекла, мыла, медицинских препаратов и взрывчатых веществ.
Рубидий и цезий обладают высокой химической активностью. Они используются в научных исследованиях, производстве оптических приборов и в электронике.
Франций, самый тяжелый и редкий из щелочных металлов, имеет очень короткую продолжительность жизни. Из-за своей редкости и радиоактивности, франций имеет ограниченные применения и используется только для научных исследований.
Химические свойства лития, натрия, калия, рубидия и цезия

Литий, натрий, калий, рубидий и цезий являются щелочными металлами, имеющими сходные химические свойства. Они относятся к первой группе (IA) периодической системы и характеризуются высокой реактивностью.
Одним из основных свойств щелочных металлов является их способность быстро реагировать с водой. При контакте с водой они образуют гидроксиды с мощными щелочными свойствами. Например, реакция натрия с водой протекает очень интенсивно, с выделением большого количества тепла. Это свойство делает металлы этой группы хорошими веществами для применения в щелочных батареях и процессах электролиза.
Еще одним химическим свойством щелочных металлов является их способность реагировать с кислородом. При контакте с кислородом они образуют оксиды, которые обладают сильными щелочными свойствами и используются в различных процессах промышленности. Например, калий и натрий оксиды используются в восстановительных процессах, а оксиды рубидия и цезия могут быть использованы как катализаторы в химической промышленности.
Кроме того, щелочные металлы обладают высокой электроотрицательностью. Это свойство позволяет им образовывать стабильные ионные связи с другими элементами и входить в состав различных химических соединений. Например, хлориды лития, натрия, калия, рубидия и цезия широко используются в медицине, ацетаты калия и лития применяются в процессах синтеза органических соединений.
Щелочные металлы в природе и производственное использование

Щелочные металлы - группа элементов периодической системы, включающая литий, натрий, калий, рубидий, цезий и франций. Они являются самыми реактивными металлами, обладают низкой плотностью и очень низкой точкой плавления. Щелочные металлы встречаются в природе в виде солей и могут быть извлечены из них с помощью различных химических процессов.
Щелочные металлы имеют широкое применение в различных промышленных отраслях. Они используются в производстве щелочных батарей и главных элементов преобразователей энергии. Литий и его соединения применяются в производстве аккумуляторов для электромобилей и портативной электроники.
Натрий, калий и их соединения широко применяются в пищевой, фармацевтической и стекольной промышленности. Калийная сода используется в качестве пищевой добавки и в процессе обработки стекла. Рубидий и цезий находят применение в научных исследованиях, электронике и оптике, а также в производстве атомных часов и локаторов радаров.
В целом, щелочные металлы играют важную роль в промышленности и научных исследованиях. Их уникальные свойства и широкий спектр применения делают их важными элементами современной технологии и науки.
Происхождение щелочных металлов и способы их получения

Щелочные металлы – это элементы первой группы периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Происхождение этих металлов связано с их образованием в процессе звездной эволюции.
Основные способы получения щелочных металлов включают использование различных химических реакций и методов экстракции. Например, литий может быть получен из минералов, таких как лепидолит и сподумен, путем щелочной обработки. Натрий обычно получают из солей, таких как хлорид натрия, с помощью электролиза.
Калий является одним из самых распространенных элементов на Земле и может быть получен из природных соляных отложений или с помощью промышленных процессов. Рубидий и цезий обнаруживаются в ряде природных источников, таких как граниты и минералы калия, и могут быть извлечены с использованием различных химических реакций.
Способы получения франция достаточно ограничены из-за его высокой радиоактивности и короткого периода полураспада. Однако, использование ядерных реакций позволяет получить небольшие количества этого элемента.
В целом, щелочные металлы имеют широкое применение в различных отраслях промышленности, науке и технологии благодаря своим уникальным физическим и химическим свойствам.
Физические свойства щелочных металлов

Щелочные металлы - это группа элементов, включающая литий, натрий, калий, рубидий, цезий и франций. У них есть несколько характерных физических свойств.
Во-первых, щелочные металлы обладают низкой плотностью и мягкостью. Например, литий, самый легкий из них, имеет плотность около 0,53 г/см³. Также эти металлы очень мягкие и могут быть нарезаны ножом на тонкие пластинки.
Во-вторых, щелочные металлы обладают низкой точкой плавления и кипения. Натрий , к примеру, плавится при температуре всего лишь 97,8 °C, а его кипящая точка составляет 883 °C. Это связано с тем, что атомы этих металлов образуют слабые связи металлической сетки, что позволяет им переходить в жидкое состояние при низких температурах.
В-третьих, щелочные металлы обладают высокой электропроводимостью. Они являются отличными проводниками тока и в большинстве случаев относятся к группе лучших металлических проводников. Это объясняется наличием свободных электронов, которые легко перемещаются между атомами, обеспечивая электропроводность.
Наконец, щелочные металлы имеют высокую реактивность и очень быстро окисляются воздухом. Они реагируют с кислородом из воздуха и образуют оксиды металлов, которые могут воспламеняться. Поэтому эти металлы обычно хранятся в специальных сосудах, наполненных инертным газом, чтобы предотвратить их окисление.
Плотность, температура плавления и кипения щелочных металлов
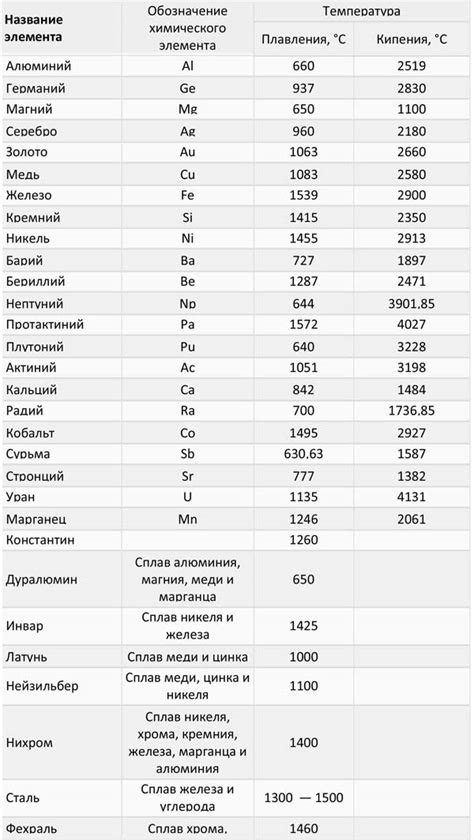
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают уникальными свойствами, которые связаны с их плотностью, температурой плавления и кипения.
Плотность щелочных металлов является одной из их основных характеристик. Она определяет массу этих металлов в единице объема. Например, у лития плотность равна 0,53 г/см³, у натрия - 0,97 г/см³, у калия - 0,86 г/см³. Щелочные металлы имеют низкую плотность, что обуславливает их легкость и мягкость.
Температура плавления и кипения щелочных металлов также отличается от обычных металлов. Например, литий плавится при температуре 180,5 градусов по Цельсию, а кипит при 1342 градусах. Натрий плавится при 97,8 градусах и кипит при 883 градусах. Калий плавится при 63,4 градусах и кипит при 774 градусах. Рубидий имеет температуру плавления 38,89 градусов и температуру кипения 688 градусов. Цезий имеет самую низкую температуру плавления - 28,5 градусов - и температуру кипения 671 градус.
Эти особенности плотности, температуры плавления и кипения делают щелочные металлы востребованными в различных областях. Например, они используются в производстве пиротехнических смесей, батарей, сплавов и многих других промышленных и научных отраслях.
Химические реакции и соединения щелочных металлов

Щелочные металлы, включающие литий, натрий, калий, рубидий, цезий и франций, обладают высокой реакционной способностью и образуют разнообразные химические соединения. Одной из характерных реакций щелочных металлов является диспропорционирование – реакция, в результате которой одна часть вещества окисляется, а другая часть вещества восстанавливается, то есть изменяет свою степень окисления.
Например, литий может диспропорционировать в присутствии кислорода, образуя пероксид лития (Li2O2) и гидроксид лития (LiOH). Эта реакция может быть представлена уравнением:
2Li + O2 → Li2O2
4Li + 2H2O → 4LiOH + H2
Щелочные металлы также образуют соединения с галогенами – фтором, хлором, бромом и иодом. Например, реакция натрия с хлором приводит к образованию хлорида натрия (NaCl), которая широко известна как поваренная соль. Уравнение реакции:
2Na + Cl2 → 2NaCl
Щелочные металлы также могут образовывать соединения с кислородом, образуя оксиды. Например, калий при взаимодействии с кислородом образует оксид калия (K2O). Уравнение реакции:
4K + O2 → 2K2O
Кроме того, щелочные металлы играют важную роль в реакциях активирования органических соединений. Например, натрий может быть использован для активации галогенов (хлора, брома и иода) при замещении атомов в органических соединениях.
Таким образом, химические реакции и соединения щелочных металлов имеют важное значение в главных областях химии и находят применение в различных процессах и технологиях, включая производство лекарств, катализаторов, взрывчатых веществ и других промышленных продуктов.
Реакция щелочных металлов с кислородом, водой и кислотами
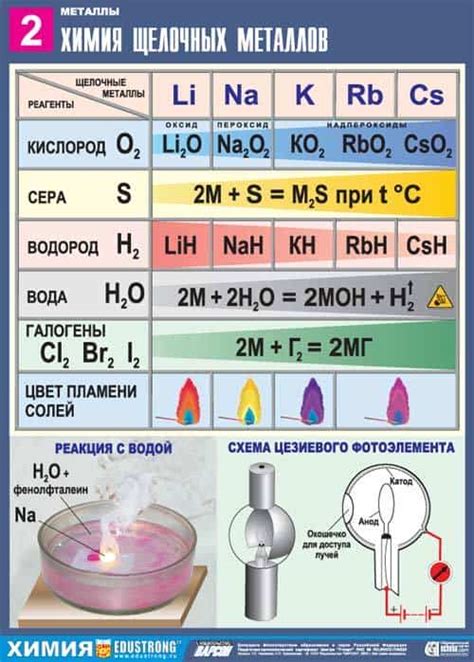
Щелочные металлы - это группа элементов, включающая литий, натрий, калий, рубидий, цезий и франций. У этих металлов есть примечательные реакции с кислородом, водой и кислотами, которые делают их полезными и важными в различных областях.
Когда щелочные металлы взаимодействуют с кислородом, они образуют оксиды. Такие реакции могут быть крайне реактивными и сопровождаются выделением большого количества тепла и света. Например, литий горит с ярким пламенем, когда взаимодействует с кислородом в воздухе.
Щелочные металлы также реагируют с водой, образуя щелочные растворы и выделяя водород. Эти реакции очень важны в различных промышленных и химических процессах. Например, натрий активно используется в производстве щелочей, а калий - в присутствии влаги реагирует с воздухом, образуя щелочную выщелаченную соль, которая используется в производстве мыла.
Когда щелочные металлы взаимодействуют с кислотами, они образуют соли и выделяют водород. Это реакция нейтрализации, которая может быть сопровождена выделением тепла и пены. Например, натрий реагирует с соляной кислотой, образуя хлорид натрия и выделяя водород. Эта реакция широко используется, например, в производстве пищевых добавок и фармацевтических препаратов.
Щелочные металлы в промышленности и медицине

Щелочные металлы - это группа химических элементов, которые отличаются высокой реактивностью и растворимостью в воде. Они играют важную роль в промышленности и медицине благодаря своим уникальным свойствам.
В промышленности щелочные металлы используются в различных областях. Например, натрий широко применяется в производстве стекла, мыла и щелочных батарей. Калий используется в производстве удобрений, а также в процессе изготовления стекла и мыла. Литий находит свое применение в производстве аккумуляторов, керамики и лекарственных препаратов.
В медицине щелочные металлы также играют важную роль. Калий, например, является необходимым элементом для нормального функционирования сердца и мышц. Натрий используется в растворах для инфузий и регулирования водно-солевого баланса в организме. Литий применяется в лекарственных препаратах для лечения биполярного аффективного расстройства.
Однако следует отметить, что щелочные металлы имеют высокую реактивность и могут быть опасными для здоровья и окружающей среды. Поэтому при работе с ними необходимо соблюдать соответствующие меры предосторожности и использовать специальную защитную экипировку.
В заключение, щелочные металлы - это важные элементы промышленности и медицины. Их уникальные свойства делают их незаменимыми в различных областях. Однако необходимо помнить об их реактивности и принимать меры предосторожности при работе с ними.
Вопрос-ответ

Какие свойства имеют щелочные металлы?
Щелочные металлы - это элементы 1-й группы периодической таблицы, включающие литий, натрий, калий, рубидий, цезий и франций. Они обладают рядом характерных свойств: низкой плотностью, низкой температурой плавления и кипения, мягкостью, серебристым цветом, химической реактивностью. Они также обладают высокой реакционной способностью с водой и кислородом.
Какие применения имеют щелочные металлы?
Щелочные металлы имеют широкое применение в различных отраслях. Например, натрий используется в производстве стекла, мыла, щелочей, а также в пищевой промышленности для консервирования. Калий применяется в удобрениях, стеклянной и электронной промышленности. Литий встречается в аккумуляторах, керамике и фармацевтике. Рубидий и цезий находят применение в оптоэлектронике и ядерной энергетике.
Какие опасности представляют щелочные металлы?
Щелочные металлы могут быть опасными при неправильном обращении с ними. Они реагируют с водой с выделением водорода, что может привести к возгоранию или взрыву. Они также реагируют с кислородом, образуя окислители, которые способны вызывать ожоги. Контакт с щелочными металлами может вызвать раздражение кожи и глаз, а вдыхание их паров может вызвать различные заболевания органов дыхания. Поэтому при работе с щелочными металлами необходимо соблюдать соответствующие меры безопасности.
Какие ионы образуют щелочные металлы?
Щелочные металлы образуют положительные одновалентные ионы. Например, литий образует ион Li+, натрий - Na+, калий - K+, рубидий - Rb+, цезий - Cs+, франций - Fr+. Эти ионы имеют наименьшую степень окисления и обладают высокой реакционной способностью в химических реакциях. Они также обладают высокой подвижностью в растворах и электролитических системах.
