Щелочные металлы - это группа химических элементов, которые имеют множество уникальных свойств и находят широкое применение в различных отраслях промышленности и науке. Эти элементы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы характеризуются низкой плотностью, мягкостью, низкой температурой плавления и высокой реактивностью.
Одним из основных свойств щелочных металлов является их способность активно реагировать с водой, чтобы образовать щелочные растворы. Это свойство делает их незаменимыми компонентами в различных химических процессах и производстве. Например, натрий широко используется в производстве мыла и моющих средств, а калий применяется в производстве удобрений и взрывчатых веществ.
Кроме того, щелочные металлы имеют высокую электропроводность и используются в производстве аккумуляторов и батарей. Они также используются в процессе охлаждения реакторов ядерной энергетики и при создании специальных типов стекла, таких как стекло для телевизоров и компьютерных мониторов.
Щелочные металлы имеют широкий спектр применения и играют важную роль в различных отраслях промышленности и науке.
Однако, несмотря на все их преимущества, щелочные металлы также обладают некоторыми недостатками. Их высокая реактивность делает их чувствительными к окислению и взаимодействию с кислородом воздуха, что приводит к быстрой коррозии и образованию оксидной пленки на их поверхности.
В целом, щелочные металлы играют важную роль в нашей жизни и применяются во множестве различных областей. Изучение их свойств и применение в различных технологиях позволяют улучшить нашу жизнь и развитие индустрии.
Структура и свойства щелочных металлов
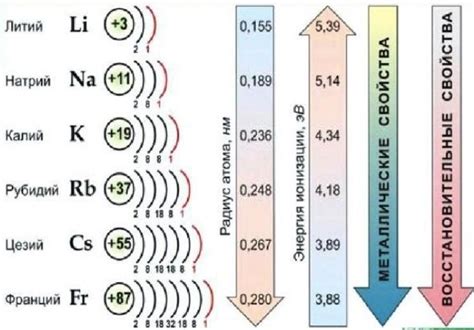
Щелочные металлы - это группа элементов, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы расположены в первой группе периодической таблицы и имеют схожую электронную конфигурацию, отличающуюся только количеством электронов в внешней энергетической оболочке.
Структура щелочных металлов является кристаллической и простой. Каждый атом щелочного металла имеет один внешний электрон (s-электрон), который легко отделяется от атома. Именно из-за наличия этого свободного электрона щелочные металлы обладают высокой реактивностью.
Свойства щелочных металлов включают низкую плотность, низкую температуру плавления и кипения, и высокую электропроводность. Несмотря на свою низкую плотность, щелочные металлы относительно мягкие и могут быть легко рассечены ножом. Они также хорошо растворяются в водах, образуя щелочные растворы.
Щелочные металлы обладают способностью взаимодействовать с кислородом, водой и другими неорганическими соединениями. Они реагируют с водой, выделяя водород, и могут восстановить множество неорганических соединений. Щелочные металлы также являются хорошими проводниками тепла и электричества, что делает их полезными для применения в электрических цепях и других электронных устройствах.
Химические свойства щелочных металлов

Щелочные металлы - группа химических элементов, которые относятся к первой группе периодической системы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Химические свойства щелочных металлов обусловлены их электронной конфигурацией и высокой активностью.
Щелочные металлы хорошо растворяются в воде, образуя щелочные растворы. Они образуют ионы металла с положительным зарядом, которые обладают большой электроотрицательностью и способны образовывать ионные связи с атомами других элементов. Это делает щелочные металлы активными химическими агентами, способными вступать в реакции с различными веществами.
Другой характерной свойствою щелочных металлов является высокая реактивность при взаимодействии с кислородом. Они образуют оксиды, которые могут иметь различные степени окисления, например, литий окисел (Li2O) или пероксид натрия (Na2O2). Щелочные металлы также способны образовывать супероксиды и пероксиды при реакции с кислородом.
Еще одним важным свойством щелочных металлов является их способность образовывать амфотерные соединения. Например, оксиды щелочных металлов могут реагировать как с кислотами, так и с основаниями, образуя соли. Это обусловлено наличием свободных электронов внешнего электронного слоя, которые могут участвовать в обменных реакциях с атомами других элементов.
Физические свойства щелочных металлов

Щелочные металлы – это группа элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они отличаются рядом уникальных физических свойств, которые делают их важными в различных областях науки и промышленности.
Первое физическое свойство, которое присуще щелочным металлам, это низкая плотность. У них очень маленькая масса на единицу объема, что делает их легкими и податливыми к физическим изменениям. Благодаря этому свойству, щелочные металлы используются в производстве легких материалов и конструкций, а также в аэронавтике и автомобилестроении.
Второе важное физическое свойство щелочных металлов – это низкая температура плавления. Например, у натрия она составляет всего 97,8 градусов Цельсия. Это позволяет использовать щелочные металлы в производстве высокотемпературных материалов и покрытий, а также в технологиях, требующих нагрева и плавления веществ.
Третье физическое свойство, о котором стоит упомянуть, это высокая теплопроводность. Щелочные металлы обладают способностью передавать тепло очень эффективно. Благодаря этому свойству, они широко используются в теплообменных процессах, в производстве теплоотводящих материалов и элементов, а также в термической обработке веществ.
Кроме того, щелочные металлы обладают высокой электропроводностью. Они являются отличными проводниками электрического тока и часто используются в электронике и электротехнике. Их высокая электропроводность позволяет использовать их в производстве электрических контактов, проводников и других устройств.
Важнейшие применения щелочных металлов

Литий:
- Используется в производстве легковесных аккумуляторов для электронных устройств, портативных компьютеров и электромобилей.
- Применяется в фармацевтике для производства препаратов, используемых при лечении психических расстройств.
- Используется в металлургической промышленности для получения легких и прочных сплавов.
Натрий:
- Широко используется в пищевой промышленности как пищевая добавка E 500, а также для приготовления различных пищевых продуктов.
- Используется в химической промышленности для производства щелочей, соды и других химических соединений.
- Применяется в металлургии для получения алюминия и других металлов.
Калий:
- Используется в сельском хозяйстве для удобрений, так как является важным макроэлементом для растений.
- Применяется в медицине, например, для производства препаратов, используемых при болезнях сердца и почек.
- Используется в производстве мыла, стекла и керамики.
Цезий:
- Находит применение в научных исследованиях, например, в пучковых ускорителях и атомных часах.
- Используется в рентгеновской спектроскопии для получения высококачественных спектров.
- Применяется в производстве катализаторов и химических реагентов.
Франций:
- Используется в научных исследованиях, например, в физике высоких энергий и атомных часах.
- Применяется в производстве катализаторов и химических реагентов.
Щелочные металлы находят широкое применение в различных отраслях промышленности, науки и биологии благодаря своей химической активности и уникальным свойствам. Из-за своей реактивности и высокой химической активности, щелочные металлы требуют специальных условий хранения и использования. Несмотря на это, эти элементы являются важными и необходимыми в многих сферах нашей жизни.
Опасности использования щелочных металлов
Щелочные металлы представляют собой группу химических элементов, включающую литий, натрий, калий, рубидий, цезий и франций. Несмотря на их широкое применение в различных отраслях промышленности, необходимо учитывать их потенциальные опасности.
Одной из основных опасностей использования щелочных металлов является их высокая реактивность. Взаимодействие с кислородом воздуха может привести к возникновению пламени и взрыву. Поэтому при работе с щелочными металлами необходимо соблюдать особую осторожность и применять специальные меры безопасности.
Еще одной опасностью является реакция щелочных металлов с водой. При контакте с водой они выделяют значительное количество водорода, который является взрывоопасным газом. Поэтому при хранении или транспортировке щелочных металлов необходимо предпринимать меры для предотвращения их контакта с водой, чтобы избежать аварийных ситуаций.
Также важно учитывать, что некоторые щелочные металлы, например калий и рубидий, могут вызывать ожоги при контакте с кожей или слизистыми оболочками человека. Поэтому при работе с этими веществами необходимо использовать специальный защитный снаряжение, такое как защитные рукавицы и очки.
Наконец, эти металлы могут быть также опасными для окружающей среды. Контакт с почвой или водой может привести к загрязнению и негативным экологическим последствиям. Поэтому утилизация отходов, содержащих щелочные металлы, требует особой осторожности и соблюдения специальных правил.
Перспективы развития использования щелочных металлов
Щелочные металлы, такие как литий, натрий, калий и другие, обладают уникальными физическими и химическими свойствами, которые делают их востребованными в различных отраслях промышленности и науки.
Одной из перспектив развития использования щелочных металлов является их применение в сфере энергетики. Литий, например, широко используется в производстве литиевых ионных аккумуляторов, которые являются ключевым компонентом мобильных устройств, электромобилей и солнечных батарей. Благодаря своей высокой энергоемкости и низкому весу, литиевые аккумуляторы обеспечивают долгое время автономной работы и значительно сокращают зависимость от традиционных источников энергии.
Второй перспективной областью развития использования щелочных металлов является каталитическая химия. Натрий и калий, например, могут быть использованы в качестве катализаторов для различных химических реакций, таких как процессы синтеза и гидрогенирования. Они обладают высокой активностью и способностью к саморегенерации, что делает их привлекательными для промышленности.
Еще одним перспективным направлением развития использования щелочных металлов является использование их в качестве катализаторов в процессах электролиза. Натрий и калий могут служить эффективными катализаторами для разложения воды и получения водорода, который может быть использован как чистое топливо. Это имеет большое значение в разработке экологически чистых источников энергии и снижении зависимости от нефтепродуктов.
Таким образом, использование щелочных металлов имеет огромный потенциал и представляет собой перспективное направление в различных сферах применения. Однако, необходимо проводить дальнейшие исследования и разработки для оптимизации и повышения эффективности и надежности технологий использования щелочных металлов.
Вопрос-ответ

В чем заключается роль щелочных металлов в химической промышленности?
Щелочные металлы играют важную роль в химической промышленности. Они используются в производстве щелочей, стекла, мыла, а также в процессах добычи и очистки ряда металлов.
Какие свойства отличают щелочные металлы от других химических элементов?
Щелочные металлы обладают рядом уникальных свойств. Они являются очень реактивными, легко окисляются, образуя окиси и пероксиды. Они активно реагируют с водой, образуя щелочные растворы. Кроме того, они имеют низкую плотность, низкую температуру плавления и высокую электропроводность.
Каково влияние щелочных металлов на человека и окружающую среду?
Щелочные металлы могут быть опасными для человека и окружающей среды. Они могут вызывать ожоги на коже и раздражение глаз. Взаимодействие щелочных металлов с водой может привести к образованию взрывоопасных газов. Кроме того, выбросы щелочных металлов в окружающую среду могут вызывать загрязнение водоемов и почвы.
Какие металлы относятся к щелочным?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), и франций (Fr). Эти металлы находятся в первой группе периодической системы элементов.
Какие применения имеют щелочные металлы в современных технологиях?
Щелочные металлы имеют широкий спектр применений в современных технологиях. Например, литий используется для производства аккумуляторов, натрий используется в промышленности стекла и мыла, а калий применяется в сельском хозяйстве как удобрение. Рубидий и цезий используются в научных исследованиях и в производстве электроники. Франций, самый редкий щелочной металл, имеет ограниченное применение из-за своей высокой реактивности и короткого периода полураспада.
