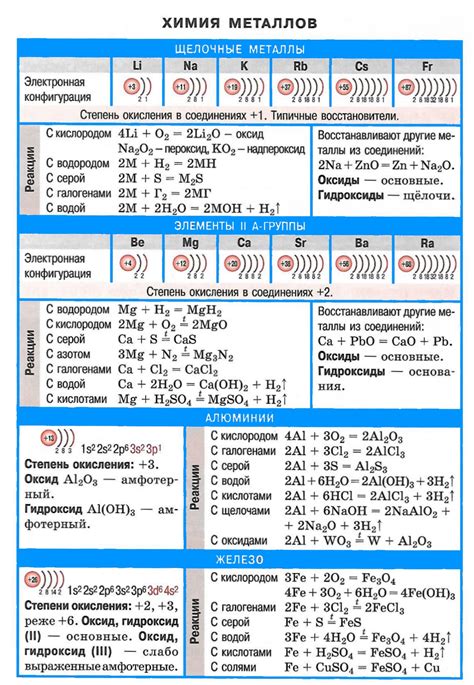
Щелочные металлы – это элементы первой группы периодической системы, с ярко выраженной щелочной активностью. Эта группа включает такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs).
Взаимодействие щелочных металлов с водой – одна из наиболее известных и исследованных химических реакций. Когда щелочные металлы попадают в контакт с водой, происходит реакция, в результате которой образуются гидроксиды щелочных металлов и выделяется водородный газ.
Химическую формулу этой реакции можно записать следующим образом:
2M + 2H2O → 2MOH + H2
где M – обозначает щелочный металл.
Реакция взаимодействия щелочных металлов с водой является экзотермической и сопровождается выделением тепла. При этом образуется гидроксид щелочных металлов, который является сильным основанием и обладает рядом полезных свойств, таких как растворимость в воде и способность нейтрализовать кислоты.
Щелочные металлы и их химические свойства
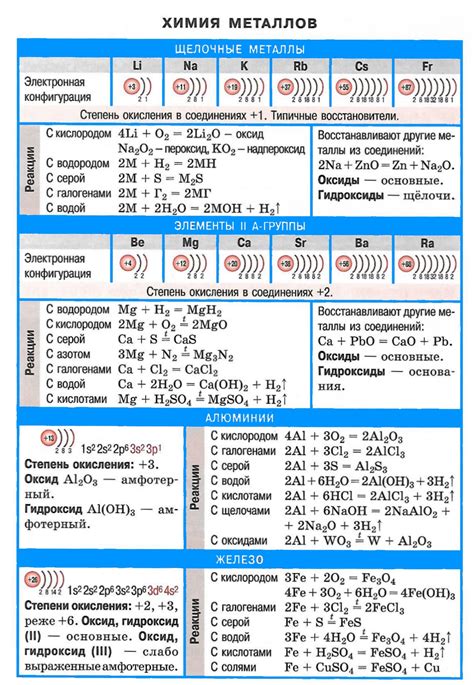
Щелочные металлы — это элементы первой группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой реакционной способностью и активностью.
Эти металлы имеют общую химическую формулу MO, где M обозначает щелочный металл, а O — кислород. Они образуют ионы M+, которые обладают положительным зарядом. Щелочные металлы обладают низкой плотностью и точкой плавления, а также мягкостью и низкой твердостью.
Одним из главных химических свойств щелочных металлов является их реакция с водой. При взаимодействии с водой они образуют щелочные гидроксиды и высвобождают водород. Это реакция, которая сопровождается выделением большого количества тепла.
Также щелочные металлы обладают способностью реагировать с кислотами, образуя соли и высвобождая водород. Они реагируют с воздухом, образуя оксиды и нитриды.
Особенности щелочных металлов и их химические свойства делают их полезными в различных областях науки и технологии, таких как производство легких сплавов, катализаторов и лекарственных препаратов.
Щелочные металлы в периодической таблице Менделеева
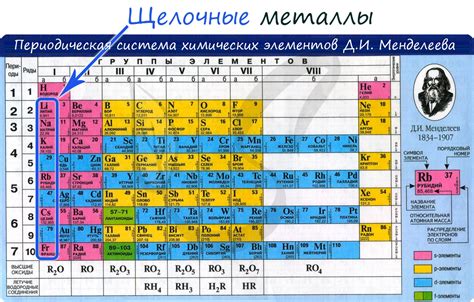
Щелочные металлы являются первой группой периодической таблицы Менделеева. Эта группа состоит из пяти элементов: лития (Li), натрия (Na), калия (K), рубидия (Rb) и цезия (Cs). Щелочные металлы отличаются своими химическими свойствами, включая активность и реакцию с водой.
Литий (Li) - самый легкий и наименее реактивный из щелочных металлов. Он имеет атомный номер 3 и находится в первом периоде таблицы Менделеева. Литий обладает низкой плотностью и может быть использован в аккумуляторах. Он реагирует с водой, но не так активно, как другие щелочные металлы.
Натрий (Na) - второй элемент в щелочной металлической группе с атомным номером 11. Он имеет высокую реактивность и активно взаимодействует с водой. Натрий используется в различных промышленных процессах, а также в пищевой промышленности в качестве пищевой добавки или консерванта.
Калий (K) - третий элемент в щелочной металлической группе с атомным номером 19. Он также очень реактивный металл и может взаимодействовать с водой, выделяясь водород. Калий используется в удобрениях и является необходимым элементом для растений.
Рубидий (Rb) - четвертый элемент в группе щелочных металлов, атомный номер которого 37. Рубидий имеет высокую реактивность и может взаимодействовать с водой, образуя гидроксид рубидия. В медицине рубидий используется в радиотерапии.
Цезий (Cs) - последний элемент в щелочной металлической группе с атомным номером 55. Цезий является самым реактивным металлом среди щелочных металлов и реагирует с водой, образуя гидроксид цезия. Цезий используется в различных промышленных процессах, включая производство стекла и катализаторов.
Химические формулы щелочных металлов
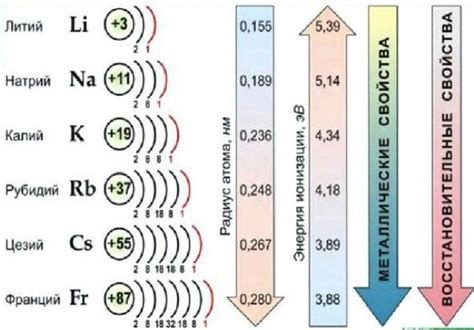
Щелочные металлы - это элементы первой группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У каждого из этих металлов есть своя уникальная химическая формула, которая обозначает его атомное составление.
Химическая формула лития - Li. Атом лития имеет 3 протона, 4 нейтрона и 3 электрона. Литий является самым легким металлом и обладает низкой плотностью и низкой температурой плавления.
Натрий имеет химическую формулу Na. Атом натрия содержит 11 протонов, 12 нейтронов и 11 электронов. Натрий широко используется в пищевой промышленности и в процессе получения щелочей.
Калий обозначается химической формулой K. Атом калия состоит из 19 протонов, 20 нейтронов и 19 электронов. Калий играет важную роль для растений и является необходимым микроэлементом в пище человека.
Рубидий имеет химическую формулу Rb. Атом рубидия содержит 37 протонов, 48 нейтронов и 37 электронов. Рубидий используется в электротехнике и в производстве лазеров.
Цезий обозначается химической формулой Cs. Атом цезия содержит 55 протонов, 78 нейтронов и 55 электронов. Цезий используется при создании атомных часов и в научных исследованиях.
Франций, самый редкий и радиоактивный элемент из группы щелочных металлов, имеет химическую формулу Fr. Атом франция содержит 87 протонов, 136 нейтронов и 87 электронов.
Щелочные металлы взаимодействуют с водой
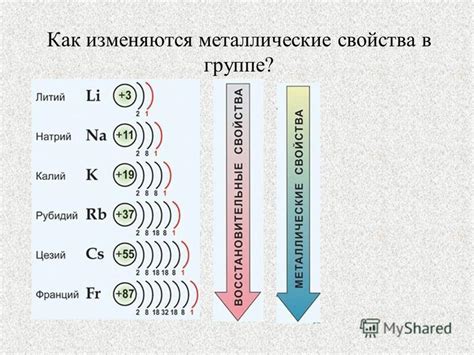
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), имеют способность активно взаимодействовать с водой. Этот процесс характеризуется выделением водорода и образованием щелочного гидроксида.
Реакция щелочных металлов с водой происходит с выделением большого количества тепла, что может вызвать ожоги или пожар. Этот процесс является экзотермическим, то есть сопровождается выделением энергии в виде тепла.
Химическую реакцию между щелочным металлом и водой можно записать следующим образом:
- Металл + Вода → Металлический гидроксид + Водород
Например, реакция лития с водой может быть записана таким образом:
- 2Li + 2H2O → 2LiOH + H2
Щелочные металлы взаимодействуют с водой очень реактивно, и реакция приводит к образованию щелочных растворов гидроксидов, которые имеют высокую щелочность. Это свойство используется в промышленности и научных исследованиях для различных целей, таких как производство щелочных батарей, очистка отходов и регулирование pH-баланса в растворах.
Таким образом, взаимодействие щелочных металлов с водой является важным химическим процессом, который имеет практическое применение и оказывает значительное влияние на многие аспекты нашей жизни.
Химические реакции щелочных металлов с водой
Щелочные металлы - это металлы, которые находятся в первой группе периодической системы элементов: литий, натрий, калий, рубидий и цезий. Реакции этих металлов с водой являются одним из самых фундаментальных и известных примеров химических реакций.
Каждый щелочный металл может реагировать с водой, образуя гидроксид (щелочь) и выделяя водород. Это реакция вида:
M + H2O -> MOH + H2
Гидроксид, образующийся в результате реакции, является щелочью. Он имеет высокую щелочность и способен реагировать с кислотами, образуя соль и воду.
Реактивность щелочных металлов с водой увеличивается по мере движения по группе от лития к цезию. Например, литий реагирует с водой очень медленно и остаточно холодная реакция, в то время как реакция рубидия и цезия происходит очень быстро и с выделением большого количества тепла.
Реакции щелочных металлов с водой также могут протекать с образованием взрыва. Например, калий и натрий могут взорваться при контакте с водой в условиях высокой температуры или при наличии неискореняющих агентов.
Все эти реакции происходят из-за высокой активности щелочных металлов, которая обусловлена их способностью отдавать электроны во внешнюю среду.
Химические свойства щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают рядом уникальных химических свойств, которые делают их высокоактивными и важными элементами в химии и промышленности.
Во-первых, щелочные металлы очень реактивны и легко взаимодействуют с водой. При контакте с водой они выделяют гидроген и образуют основание, что делает их отличными растворителями для различных веществ.
Во-вторых, щелочные металлы имеют низкую плотность и низкую температуру плавления. Литий, например, имеет самую низкую плотность среди металлов и может плавиться уже при температуре 180°C. Эти свойства делают щелочные металлы легкими и удобными для использования в различных приложениях.
В-третьих, щелочные металлы образуют стойкие и долговечные соединения со многими элементами, такими как кислород, фтор и хлор. Это позволяет им использоваться в производстве широкого спектра химических соединений и материалов, включая лекарства, взрывчатые вещества и сплавы.
Наконец, щелочные металлы обладают способностью образовывать ионы положительного заряда, что делает их важными в реакциях обмена ионами. Это позволяет использовать их в процессах очистки и смягчения воды, а также в электролизе и производстве электроэнергии.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий и калий, имеют широкое применение в различных отраслях промышленности.
- Энергетика: Литий широко используется в производстве литиевых ионных аккумуляторов, которые используются в мобильных устройствах, электромобилях и энергетических системах.
- Металлургия: Натрий используется в процессе производства алюминия методом электролиза. Калий используется в производстве солевых составов для металлического покрытия, а также в процессах легирования.
- Химическая промышленность: Литий и натрий используются для производства щелочей, едкого натра, гидроксида калия и других химических соединений.
- Стекольная промышленность: Натрий играет важную роль в процессе производства стекла, где он обеспечивает его прозрачность и стойкость к теплу.
- Производство полимеров: Литий используется в качестве сырья для производства полимеров, таких как полиэфирные смолы и полиэтилентерефталат.
Щелочные металлы обладают уникальными химическими свойствами, которые делают их незаменимыми в различных процессах промышленного производства. Использование этих металлов позволяет производить высококачественные продукты с улучшенными характеристиками.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это группа химических элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе периодической системы, так как имеют одну валентную электрон, что делает их очень реакционноспособными.
Какие свойства имеют щелочные металлы?
Щелочные металлы обладают рядом характеристических свойств. Во-первых, они очень реакционноспособны, так как имеют одну валентную электрон. Во-вторых, они легко реагируют с водой, образуя гидроксиды и высвобождая водород. В третьих, они образуют ионы с положительным зарядом, которые хорошо растворяются в воде. Кроме того, они являются мягкими металлами и имеют низкую температуру плавления и кипения. Стоит также отметить их высокую проводимость электричества и тепла.
