Строение валентного уровня щелочных металлов – одно из основных свойств, которые определяют их химическую активность и способность к реакциям. Валентный уровень представляет собой наружный энергетический уровень электронов в атоме металла, на котором находятся валентные электроны, т.е. электроны, участвующие в химических реакциях. Именно благодаря валентным электронам щелочные металлы обладают высокой активностью и нестабильностью в атоме, поэтому они очень легко участвуют в реакциях.
Строение валентного уровня щелочных металлов характеризуется наличием одного валентного электрона на этом уровне. Другими словами, уровень заполнен только одним электроном. Это означает, что каждый атом щелочного металла имеет один свободный электрон, который может быть передан другому атому в процессе химической реакции. Такое свойство валентного уровня позволяет щелочным металлам образовывать стабильные положительные ионы. При потере валентного электрона, атом металла превращается в ион, который имеет положительный заряд, равный числу произведенных потерей электронов.
Строение валентного уровня щелочных металлов демонстрирует их склонность к образованию ионных связей. Ионные связи – это притяжение между ионами с противоположными зарядами. Из-за своей высокой активности щелочные металлы вступают в реакции с галогенами (хлором, бромом, йодом), образуя ионные соединения. Например, натрий и хлор образуют ионное соединение – хлорид натрия. Этот процесс осуществляется благодаря потере валентного электрона натрием и его получение хлором. Такие простые ионные соединения обладают высокой стабильностью и являются основными составляющими щелочных металлов.
Роль валентного уровня щелочных металлов>
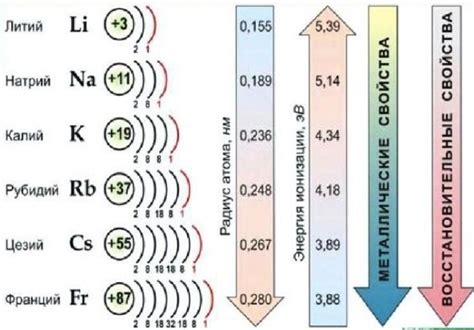
Щелочные металлы - это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. Они обладают общей химической особенностью - наличием одной электронной оболочки, которая является валентной, то есть наружной для этих элементов.
Валентный уровень щелочных металлов имеет важное значение для определения их химических свойств. На этом уровне находится один электрон, который легко отдаётся или принимается при реакциях с другими веществами.
За счет наличия свободного электрона, щелочные металлы обладают высокой реакционной способностью. Они активно взаимодействуют с водой, кислородом, галогенами и другими элементами, образуя соединения с характерными свойствами.
- Например, реакция щелочных металлов с водой в результате образуется щелочь и высвобождается водород.
- Органические соединения щелочных металлов широко используются в химической промышленности, а соли этих элементов являются важными компонентами в пищевой и фармацевтической промышленности.
- Также щелочные металлы играют важную роль в электронике и аккумуляторной промышленности благодаря своим электрохимическим свойствам.
Таким образом, валентный уровень щелочных металлов определяет их большую химическую активность и роль во многих областях науки и промышленности.
Химические свойства валентного уровня

Валентный уровень щелочных металлов является самым внешним энергетическим уровнем атома, на котором располагается валентная электронная оболочка. Химические свойства валентного уровня определяют способность атомов щелочных металлов образовывать ионные соединения и принимать участие в химических реакциях.
На валентном уровне атомы щелочных металлов обладают одним электроном, что делает их очень реакционноспособными. Это связано с тем, что атомы стремятся заполнить свой валентный уровень, чтобы достичь стабильной электронной конфигурации. Для этого атомы щелочных металлов готовы отдавать один электрон другим элементам.
Щелочные металлы проявляют сильную химическую активность в результате этой готовности отдавать электроны. Они образуют сольные соединения с кислотами, газообразными неметаллами и многими другими элементами. Эти соединения в основном имеют ионную природу и характеризуются высокой растворимостью в воде.
Также валентные электроны определяют многие физические свойства щелочных металлов, например, их высокую электропроводность и хорошую теплопроводность. Все это делает щелочные металлы важными и широко применяемыми в различных отраслях промышленности и научных исследований.
Особенности строения валентного уровня
Валентный уровень щелочных металлов представляет собой энергетический уровень, на котором находятся электроны с самой высокой энергией в атоме. Он является внешним уровнем электронной оболочки и определяет химические свойства данных металлов.
Валентный уровень щелочных металлов заполняется электронами в соответствии с правилом ауфбау, согласно которому электроны заполняют орбитали с наименьшей энергией. В результате, на валентном уровне обычно находится один или два электрона.
Основной особенностью строения валентного уровня щелочных металлов является наличие одного электрона с большим радиусом и невысокой энергией. Это обусловлено тем, что валентный электрон щелочных металлов находится далеко от ядра, что способствует слабому притяжению и, следовательно, относительно низкой энергии.
Из-за наличия всего одного электрона на валентном уровне, щелочные металлы имеют большую склонность к образованию ионов с положительным зарядом. Это объясняет их активность и способность легко вступать в химические реакции.
Взаимодействие валентного уровня с другими элементами
Валентный уровень щелочных металлов является наиболее внешним уровнем электронов в атоме, и именно на нем происходят основные химические реакции. Взаимодействие валентного уровня с другими элементами определяет химические свойства щелочных металлов и их способность образовывать соединения с другими веществами.
Валентный уровень щелочных металлов содержит один электрон, что делает их крайне реакционноспособными. Эти элементы стремятся отдать этот электрон, чтобы достичь семьи инертных газов и получить полную октетную электронную конфигурацию. Поэтому щелочные металлы легко реагируют с другими элементами, особенно с неметаллами, образуя ионные соединения.
При взаимодействии с неметаллами, валентный электрон щелочного металла передается неметаллу, что приводит к образованию положительно заряженного иона щелочного металла и отрицательно заряженного иона неметалла. Эти ионы притягиваются друг к другу электростатическими силами, образуя ионную связь.
Также валентный уровень щелочных металлов может взаимодействовать с валентным уровнем других металлов, что приводит к образованию металлической связи. Щелочные металлы имеют характеристику низкой электроотрицательности, что обусловливает их способность отдавать электроны и образовывать катионы. Поэтому они часто встречаются в амальгамах с другими металлами.
Взаимодействие валентного уровня щелочных металлов с другими элементами определяет широкое применение этих металлов в различных областях науки и техники, а также их роль в биохимических процессах.
Вопрос-ответ

Каково строение валентного уровня щелочных металлов?
Строение валентного уровня щелочных металлов характеризуется наличием одного электрона во внешней оболочке. Этот электрон находится на s-подуровне, что делает щелочные металлы очень реактивными и склонными к образованию ионов с положительным зарядом.
Как выглядит валентный уровень щелочных металлов?
Валентный уровень щелочных металлов представляет собой полностью заполненный внутренний слой электронов и один электрон на внешнем s-подуровне. Это делает их электронную конфигурацию очень устойчивой и обуславливает их химические свойства.
