Щелочные металлы представляют собой группу элементов в периодической таблице химических элементов. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Названы они так в связи с тем, что их оксиды растворяются в воде, образуя щелочные растворы. Щелочные металлы являются крайне реактивными и имеют низкую плотность.
У каждого щелочного металла есть свои уникальные химические и физические свойства. Например, литий характеризуется низкой плотностью и низкой температурой плавления, что делает его идеальным материалом для аккумуляторов. Натрий обладает более высокой плотностью и используется в производстве щелочей, стекла и сплавов. Калий является важным элементом для растений и используется в сельском хозяйстве.
Большинство щелочных металлов имеют низкую температуру плавления и кипения, что делает их хорошими проводниками тепла и электричества. Они также легко окисляются воздухом и реагируют с водой, выделяя горючие водородные газы. Щелочные металлы часто используются в лабораторной практике, в производстве лекарственных препаратов и в других промышленных процессах.
Список щелочных металлов:
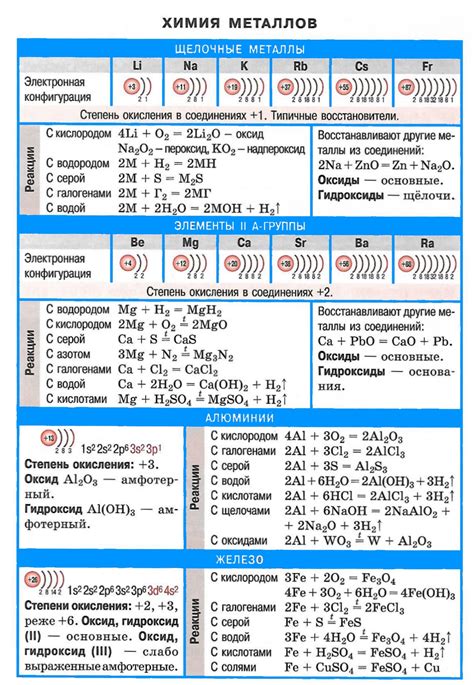
Щелочные металлы - это группа химических элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они отличаются высокой реактивностью и активностью, и часто вступают в реакции с другими веществами.
Литий: Литий является самым легким из щелочных металлов. Он имеет низкую плотность и воспламеняется при контакте с водой. Литий используется в производстве литиевых батарей, сплавов для авиации и лекарственных препаратов.
Натрий: Натрий - сильный редуктор и обладает высокой активностью. Он используется в производстве щелочей, мыла, стекла и алюминия. Натрий также играет важную роль в регуляции водного и электролитного баланса в организмах живых существ.
Калий: Калий также является очень активным металлом. Он широко используется в сельском хозяйстве в качестве удобрения. Калийные соединения применяются в производстве стекла, мыла, добывают калийную соль для промышленности.
Рубидий: Рубидий в небольших количествах присутствует в земле, но его извлечение из земли является сложным процессом. Рубидий применяется в научных исследованиях, производстве ламп и оптических приборов.
Цезий: Цезий является самым реактивным из щелочных металлов. Он часто используется в научных исследованиях и в производстве электронных приборов.
Франций: Франций - редкий и радиоактивный элемент. В связи с тем, что франций тяжелый и стабилитрон, его изучение и использование ограничено.
В целом, щелочные металлы играют важную роль в различных сферах, таких как электроника, медицина и сельское хозяйство. Их свойства и активность делают их полезными и востребованными в различных технологических процессах и приложениях.
Описание щелочных металлов

Щелочные металлы - это особая группа химических элементов, которые характеризуются своей активностью и реактивностью. К этой группе относятся литий, натрий, калий, рубидий, цезий и франций.
Основными свойствами щелочных металлов являются их низкая плотность, низкая температура плавления и кипения, мягкость и невысокая твердость. Кроме того, они обладают высокой электропроводностью и отличаются яркой окраской пламени при горении в воздухе.
Щелочные металлы хорошо растворяются в воде, что позволяет им выступать в качестве сильных оснований. Они образуют гидроксиды, которые хорошо растворимы и образуют щелочные растворы с щелочной реакцией. Кроме того, щелочные металлы реагируют с кислородом, хлором и другими не металлами.
Щелочные металлы широко используются в различных сферах науки и производства. Например, литий применяется в производстве аккумуляторов, калий используется в сельском хозяйстве как удобрение, натрий широко используется в производстве стекла и мыла.
Необходимо отметить, что щелочные металлы являются очень активными химическими элементами. Они реагируют с веществами, на которые другие металлы не оказывают влияния. Поэтому они хранятся в специальных условиях, чтобы избежать нежелательных реакций.
Химические свойства щелочных металлов

Щелочные металлы представляют собой группу химических элементов, которые обладают рядом характерных свойств. Они включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Важной особенностью щелочных металлов является их высокая реактивность. При контакте с воздухом они быстро окисляются, образуя оксидные пленки на поверхности, что может привести к их коррозии. Из-за этого щелочные металлы обычно хранят под слоем инертного газа, такого как аргон или ксенон.
Щелочные металлы проявляют яркую реакцию с водой, образуя сильно щелочные растворы. При взаимодействии с водой они выделяются водород и образуют гидроксиды. Например, литий образует гидроксид лития (LiOH), натрий - гидроксид натрия (NaOH) и т.д.
Кроме того, щелочные металлы имеют низкую плотность и низкую температуру плавления. Например, литий - легчайший из щелочных металлов и обладает наименьшей плотностью из всех элементов. Они также являются отличными проводниками тепла и электричества.
Щелочные металлы обладают хорошей активной способностью и часто используются в химических реакциях и промышленности. Литий используется в батареях, натрий - в производстве стекла, калий - в удобрениях, а рубидий и цезий - в научных исследованиях и электронике.
Применение щелочных металлов

Щелочные металлы - это группа элементов периодической таблицы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих элементов много полезных свойств, которые нашли свое применение в различных областях человеческой деятельности.
Первым важным применением щелочных металлов является использование их в производстве щелочных батарей. Литий-ионные аккумуляторы, содержащие литий, обладают высокой энергоемкостью и используются в различных электронных устройствах, таких как мобильные телефоны, ноутбуки и электрические автомобили. Калий и натрий также используются в некоторых типах батарей, особенно в больших промышленных системах.
Вторым важным применением щелочных металлов является их применение в производстве стекла и керамики. Натрий является необходимым компонентом стекла, он придает ему прочность и устойчивость к разрушению. Калий используется при производстве стеклотары и карфагенских стаканов. Литий нашел свое применение в производстве прочного высокотемпературного кристаллического стекла.
Третьим важным применением щелочных металлов является их использование в химической промышленности. Калий и натрий используются в производстве удобрений, которые являются необходимыми для повышения урожайности сельскохозяйственных культур. Рубидий используется в научных исследованиях, включая применение в атомных часах и лазерных устройствах. Цезий используется для производства катода в телевизионных экранах.
В заключение, щелочные металлы имеют широкое применение в различных отраслях промышленности. Они играют важную роль в энергетике, производстве стекла и керамики, а также в химической промышленности. Использование щелочных металлов продолжает развиваться, и они остаются важными элементами нашей современной технологической жизни.
Вопрос-ответ

Зачем нужно знать список щелочных металлов?
Знание списка щелочных металлов важно для понимания их свойств и возможностей использования в различных областях науки и технологий.
Какие элементы входят в список щелочных металлов?
В список щелочных металлов входят следующие элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие свойства характерны для щелочных металлов?
Щелочные металлы обладают низкими плотностью и точками плавления, легко ионизируются, образуя положительные одновалентные ионы, являются хорошими проводниками электричества и тепла.
Какие применения могут иметь щелочные металлы?
Щелочные металлы находят широкое применение в различных областях, включая производство легированных сплавов, химической промышленности, производстве стекла, электролитическом никеле и др.
