Щелочные металлы - это удивительная группа элементов, которые обладают великолепными химическими свойствами. В число щелочных металлов входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы являются мощными восстановителями и широко используются в различных областях науки и промышленности.
Одним из интересных свойств щелочных металлов является их способность реагировать с кислородом воздуха. При контакте с воздухом, щелочные металлы образуют оксиды, которые характеризуются яркой окраской. Например, литий образует оксид с красной окраской, а калий - с фиолетовой. Это свойство позволяет использовать щелочные металлы для окрашивания стекла и керамики.
Кроме того, щелочные металлы обладают очень низкой плотностью, что делает их идеальными материалами для создания легких конструкций в авиационной и космической промышленности. Например, литий является основным компонентом легкого сплава, используемого в производстве алюминиевых авиационных конструкций.
Необычные свойства щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают целым рядом уникальных свойств, делающих их востребованными в различных сферах науки и техники.
Одно из самых известных свойств щелочных металлов - их способность активно реагировать с водой. При контакте с водой щелочные металлы быстро реагируют, образуя водород и щелочные гидроксиды. Этот процесс сопровождается выделением большого количества тепла, что делает эти металлы идеальными для использования в реактивных системах или в качестве источников энергии.
Еще одним необычным свойством щелочных металлов является их низкая плотность. Литий, наиболее легкий из щелочных металлов, имеет плотность всего 0,534 г/см³, что делает его легче, чем вода. Из-за этой свойства щелочные металлы могут плавать на поверхности воды и даже "плавать" на ртути, что отличает их от большинства других металлов.
Щелочные металлы также известны своей реактивностью с кислородом и другими элементами. Они образуют соединения, которые являются не только восстановителями, но и катализаторами для многих химических реакций. Благодаря этому свойству щелочные металлы находят применение в производстве промышленных катализаторов, лекарств и других химических веществ.
Мощные восстановители
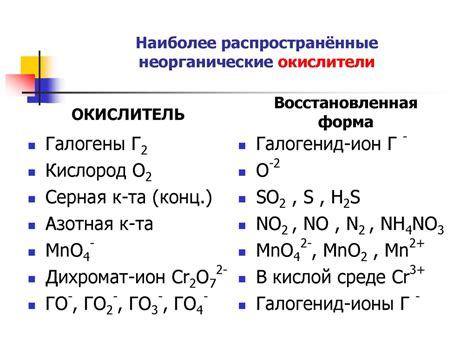
Щелочные металлы, такие как литий, натрий, калий и другие, обладают уникальными свойствами восстановления и широким спектром применения в химической и фармацевтической промышленности.
Одним из главных свойств щелочных металлов является их способность вступать в реакцию с кислородом, аммиаком и другими окислителями, снижая их активность и протекание ряда химических процессов. Это делает щелочные металлы незаменимыми в качестве мощных восстановителей во многих химических реакциях.
Также щелочные металлы широко используются в процессах электролиза, где они выступают в качестве отрицательных электродов и обеспечивают эффективный перенос заряда. Благодаря своим восстановительным свойствам, щелочные металлы способны катализировать разнообразные электрохимические реакции, в том числе водородное снижение, восстановление органических соединений и даже электрокатализ воды.
Более того, щелочные металлы играют важную роль в фармацевтической промышленности, где они используются в качестве средств для восстановления ряда лекарственных препаратов. Их способность взаимодействовать с различными соединениями и снижать их окислительный статус позволяет улучшать стабильность и эффективность многих препаратов.
Множество применений

Щелочные металлы, такие как литий, натрий, калий и др., обладают мощными восстановительными свойствами, что делает их ценными в разных областях промышленности.
Одним из важных применений щелочных металлов является использование их в батареях и аккумуляторах, где они служат в качестве электролита. Благодаря своей низкой массе и большой энергетической плотности, литий-ионные батареи становятся все более популярными в современных мобильных устройствах, таких как смартфоны и ноутбуки. Калий-ионные батареи также находят применение в электрических автомобилях и солнечных батареях.
Щелочные металлы также используются в производстве стекла. Натрий играет важную роль в процессе стеклотворения, где используется как стабилизатор для снижения точки плавления и повышения текучести стеклянной массы. Более того, щелочные металлы придают стеклу особые свойства, такие как прозрачность и прочность.
Калий и натрий также находят применение в сельском хозяйстве. Они являются важными питательными веществами для растений, участвуют в процессе фотосинтеза и регулируют осмотическое давление. Калийные и натриевые удобрения помогают повысить урожайность и качество сельскохозяйственных культур.
Другое применение щелочных металлов - в производстве сплавов и легких металлических конструкций. Литий используется, например, при создании легких и прочных сплавов для авиационной и автомобильной промышленности. Калий и натрий также находят широкое применение в металлургии и производстве различных сплавов.
Наконец, щелочные металлы также используются в медицине. Например, литий используется в лечении биполярного расстройства, а натрий используется в виде солей для регулирования баланса электролитов в организме. Эти металлы также находят применение в производстве медицинской аппаратуры и оборудования.
Создание технологических революций

Щелочные металлы, такие как литий, натрий и калий, обладают уникальными свойствами, которые могут привести к созданию технологических революций в различных областях. Их мощные восстановительные свойства позволяют использовать их в разработке новых энергетических источников, создании более эффективных батарей, а также в различных химических процессах.
В области энергетики щелочные металлы уже нашли широкое применение. Например, литий используется в литий-ионных аккумуляторах, которые являются основным источником питания для мобильных устройств, таких как смартфоны и ноутбуки. Благодаря своей высокой энергетической плотности и длительному сроку службы, литий-ионные аккумуляторы становятся все более популярными и заменяют традиционные источники электропитания.
Более того, интересные возможности для использования щелочных металлов открываются в области электромобилей. Проводителем электрического заряда в литий-ионных аккумуляторах выступает литиевый ион. Благодаря своей высокой электропроводности и легкому весу, эти аккумуляторы обеспечивают электромобилям большую мощность и дальность преодоления. Это может привести к настоящей революции в автомобильной промышленности, чтобы сделать автомобили более эффективными и экологичными.
Кроме того, щелочные металлы могут быть использованы в химических процессах, таких как производство аммиака и металлургический синтез. Натрий и калий играют важную роль в производстве ядерных реакторов, где они используются в качестве теплоносителей. Это позволяет создавать более эффективные и безопасные энергетические установки, что может привести к созданию новых технологических революций в сфере энергетики.
Взаимодействие с водой и воздухом

Щелочные металлы, такие как литий, натрий, калий и др., обладают очень активной химической реакцией с водой. При контакте с водой они быстро реагируют, выделяя горючий водород, который может даже возгораться при взаимодействии со свечой или искрой. Поэтому очень важно соблюдать осторожность при работе с щелочными металлами вблизи воды.
Без воздуха щелочные металлы не могут долго существовать. Они активно взаимодействуют с воздухом, образуя оксидные пленки на своей поверхности. Это объясняет их склонность к окислению и образованию покрытий из оксида металла.
Например, литий при взаимодействии с воздухом быстро покрывается слоем белого порошка - литиевого оксида, который является окислителем и широко используется в химической промышленности. Калий и натрий реагируют с воздухом менее активно, но тоже образуют тонкую пленку оксида на своей поверхности.
Щелочные металлы также могут реагировать с влагой из воздуха, что может привести к образованию гидроксидов металла. Натрий, например, особенно активно взаимодействует с влажным воздухом, образуя натриевый гидроксид, который широко используется в производстве мыла и чистящих средств.
Итак, взаимодействие щелочных металлов с водой и воздухом является важным аспектом их химических свойств. Это свойство их делает мощными восстановителями и находит широкое применение в различных отраслях промышленности и научных исследований.
Важность для химической промышленности

Щелочные металлы играют ключевую роль в химической промышленности благодаря своим уникальным свойствам и способности взаимодействовать с другими веществами. Одно из важных применений щелочных металлов - это их использование в процессе электролиза для получения металлов, таких как натрий, калий и литий.
Калий и натрий, например, используются в производстве стекла, моющих средств, мыла, а также в процессе синтеза органических соединений. Эти металлы обладают высокой реакционной способностью и часто используются для осуществления различных химических реакций.
Литий, в свою очередь, нашел свое применение в производстве аккумуляторов для электромобилей, мобильных устройств и других электронных устройств. Благодаря своей легкости и низкому показателю плотности, литий является идеальным выбором для создания мощных и надежных аккумуляторов.
Безопасность и меры предосторожности при работе с щелочными металлами

Щелочные металлы обладают рядом уникальных свойств, однако их использование требует особой осторожности и соблюдения определенных мер безопасности. Вот несколько основных правил, следуя которым можно минимизировать риск возникновения опасной ситуации при работе с эти металлами.
- Запасайтесь защитными средствами. Не забудьте надеть защитные очки, перчатки и фартук перед началом работы с щелочными металлами. Они помогут предотвратить контакт с кожей и глазами, что может привести к ожогам или другим травмам.
- Работайте в хорошо проветриваемом помещении. При взаимодействии щелочных металлов с водой или влажностью выделяются токсичные газы. Поэтому необходимо работать в хорошо проветриваемом помещении или использовать вытяжную вентиляцию.
- Храните щелочные металлы правильно. Целесообразно хранить щелочные металлы в специальных контейнерах, отдельно от других химических веществ, чтобы избежать их непредсказуемой реакции при случайном контакте.
- Избегайте попадания воды на щелочные металлы, так как это может привести к вспышкам или взрывам. При работе с водой вблизи щелочных металлов рекомендуется быть особенно осторожным и выполнять все действия медленно и аккуратно.
- Обязательно читайте инструкции производителя перед использованием щелочных металлов. В инструкциях указаны рекомендации по безопасности и правильному обращению с этими веществами. Не игнорируйте предупреждения и рекомендации, чтобы избежать возникновения опасной ситуации.
Правильная работа с щелочными металлами требует не только знания и понимания их свойств, но и соблюдения определенных мер безопасности. Простейшие правила безопасности, такие как использование защитной экипировки, проветривание помещения и хранение в соответствующих условиях, помогут избежать неприятных последствий и обеспечить безопасность и эффективность работы.
Вопрос-ответ

Какие свойства делают щелочные металлы мощными восстановителями?
Щелочные металлы обладают несколькими свойствами, которые делают их мощными восстановителями. Во-первых, они имеют низкую электроотрицательность и невысокую ионизационную энергию, что позволяет им легко отдавать электроны. Во-вторых, щелочные металлы обладают большой активностью, что обусловлено их низкой энергией ионизации. Благодаря этому, они могут реагировать с различными веществами, включая кислород, вода и некоторые органические соединения.
Для чего применяются щелочные металлы в промышленности?
Щелочные металлы имеют широкий спектр применений в промышленности. Одним из основных областей их применения является производство щелочных металлов и их соединений. Кроме того, они используются в процессах электролиза, а также в производстве стекла, керамики и железа. Они также широко применяются в производстве лекарственных средств, синтезе органических соединений и различных химических реакциях.
Какие могут быть применения щелочных металлов в медицине?
Щелочные металлы имеют различные применения в медицине. Например, они используются в качестве антикоагулянтов, то есть веществ, которые предотвращают свертывание крови. Они также могут использоваться для лечения отеков, вызванных сердечной недостаточностью или другими причинами. Кроме того, они играют важную роль в процессе обмена веществ и поддержании осмотического давления.
Как щелочные металлы взаимодействуют с кислородом?
Щелочные металлы являются очень активными веществами и легко взаимодействуют с кислородом. При взаимодействии с кислородом они могут образовывать оксиды, пероксиды или супероксиды щелочных металлов. Например, калий реагирует с кислородом и образует пероксид калия (K2O2). Этот пероксид может служить источником кислорода в различных химических реакциях.
