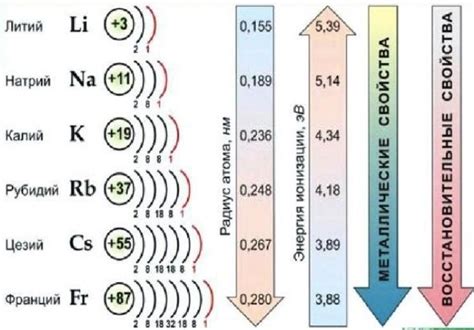
Щелочные металлы — это группа химических элементов, которые находятся в первой группе периодической системы. К ним относятся литий, натрий, калий, рубидий, цезий и франций. Все эти металлы обладают рядом уникальных особенностей и свойств.
Самой заметной характеристикой щелочных металлов является их серебристо-белый цвет. Это связано с тем, что эти металлы отражают большую часть видимого света. Они обладают высокой отражательной способностью, что делает их видимыми для нашего глаза.
Еще одной выдающейся особенностью щелочных металлов является их мягкость. Они так мягки, что могут быть резанными ножом или даже просто рукой. Это объясняется слабыми связями между атомами в их кристаллической решетке. Их мягкость также проявляется в том, что они могут быть легко сплющены или превращены в проволоку.
Щелочные металлы имеют очень низкую плотность, что делает их самыми легкими металлами. Например, литий имеет плотность всего 0,53 г/см³, а калий — 0,86 г/см³. Такая низкая плотность позволяет им плавать на поверхности воды.
Свойства щелочных металлов: уникальные характеристики группы элементов
Щелочные металлы являются группой элементов периодической таблицы, которые характеризуются рядом уникальных свойств.
Во-первых, щелочные металлы являются серебристо-белыми металлами, обладающими блестящей поверхностью. Они имеют высокую пластичность и мягкость, что позволяет легко сплющивать их и изготавливать из них различные изделия. Они также являются очень низкотемпературными, что означает, что они твердеют при невысоких температурах.
Во-вторых, щелочные металлы имеют низкую плотность, что делает их очень легкими и хорошо плавающими на воде. Их плотность уменьшается с увеличением атомного числа в периодической таблице. Эти металлы также обладают высокой теплопроводностью и электропроводностью, что делает их полезными в различных технологических и электронных приложениях.
В-третьих, щелочные металлы очень реактивны и хорошо растворяются в воде, образуя щелочные растворы с щелочной реакцией. Их реактивность возрастает с увеличением атомного числа и способствует образованию основных оксидов. Кроме того, они образуют стабильные и прочные соединения с другими элементами, такими как кислород, сера и азот.
Щелочные металлы также имеют низкую энергию ионизации, что делает их хорошими источниками электронов и позволяет им образовывать ионы положительного заряда. Они играют важную роль в химических реакциях и имеют широкие промышленные применения, включая производство щелочей, сплавов и прочих соединений.
В целом, щелочные металлы обладают уникальными характеристиками, которые делают их полезными в различных областях науки и промышленности. Их свойства и реактивность имеют большое значение в химии, электронике, энергетике и других сферах, что делает их важной группой элементов в периодической таблице.
Серебристо-белые вещества: общая черта щелочных металлов

Главной общей чертой щелочных металлов является их серебристо-белый цвет. Это свойство объясняется специфическими электронными конфигурациями атомов данных элементов, которые обусловливают особую спектральную характеристику, а именно отражение света в коротковолновой области.
Состояние поверхности присутствует и в металлическом состоянии, взаимодействует с окружающей средой и влияет на его цвет, но это влияние предположительно мало, так как свойств, характерных для металлического состояния, вполне достаточно для объяснения этого свойства.
Серебристо-белые вещества интересны не только своим цветом, но и своей мягкостью. Так, щелочные металлы отличаются низкой твёрдостью и вполне могут нарезаться ножом или сформировать след при действии небольшой силы. Это свойство объясняется особенностями электронной структуры атомов щелочных металлов, которые обладают большой межатомной дистанцией и возможностью деформации кристаллической решетки при малых усилиях.
Мягкость и пластичность: особенности щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и другие, обладают высокой степенью мягкости и пластичности. Они легко поддаются деформации и изменению формы без разрушения своей структуры. Это позволяет использовать щелочные металлы для создания различных изделий и компонентов.
Мягкость щелочных металлов объясняется их атомной структурой и химическими свойствами. Атомы этих металлов имеют один или два валентных электрона, что делает их склонными к образованию положительных ионов. В связи с этим, атомы щелочных металлов легко располагаются в кристаллической решетке и могут свободно перемещаться, обеспечивая пластичность материала.
Кроме того, щелочные металлы обладают низкой температурой плавления и кипения, что также усиливает их пластичность и способствует формированию различных изделий. Они могут быть легко сплавлены и литы при небольших температурах, что позволяет создавать сложные формы и конструкции.
Мягкость и пластичность щелочных металлов являются важными свойствами, которые делают их ценным материалом в промышленности и научных исследованиях. Они используются в производстве аккумуляторов, легких сплавов, в качестве катализаторов и других материалов.
Уникальные свойства: реакция с водой и воспламенение
Щелочные металлы обладают рядом уникальных свойств, которые делают их особенными. Одним из таких свойств является их реакция с водой.
Когда щелочные металлы вступают в контакт с водой, они начинают активно реагировать, выделяя газ и образуя гидроксиды. Например, натрий при контакте с водой реагирует
Вопрос-ответ

В чем заключаются особенности щелочных металлов?
Основными особенностями щелочных металлов являются их серебристо-белый цвет и мягкость. Они также имеют низкую плотность и низкую температуру плавления.
Почему щелочные металлы обладают серебристо-белым цветом?
Серебристо-белый цвет щелочных металлов обусловлен их электронной структурой. Щелочные металлы имеют один валентный электрон, который находится в s-орбитали. Именно этот электрон определяет их металлический блеск и светоотражающие свойства, что приводит к их серебристо-белому цвету.
