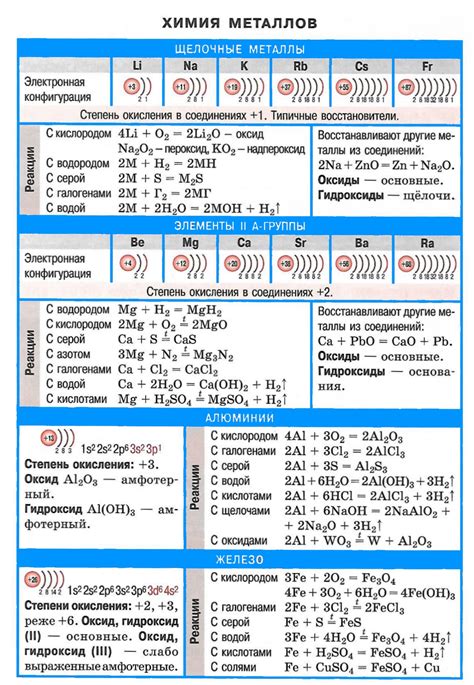
Щелочные металлы - это группа элементов периодической системы, которые включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой активностью, что позволяет им образовывать различные соединения и реагировать с другими элементами.
Солями менее активных металлов называют соединения, состоящие из одного из щелочных металлов и иона какого-либо другого менее активного металла, например, меди (Cu), цинка (Zn), железа (Fe) и других. Эти соли имеют разнообразные физические и химические свойства, которые определяют их возможности в различных химических реакциях.
Реакции щелочных металлов с солями менее активных металлов могут протекать по разным механизмам. Например, при взаимодействии меди с натрием образуется натриевая соль медной кислоты, сопровождающаяся выделением светло-голубого цвета. Эта реакция основывается на окислительно-восстановительном процессе, в результате которого купрус окисляется и ион натрия восстанавливается.
Изучение химии щелочных металлов и их реакций с солями менее активных металлов представляет большой интерес в научных и промышленных кругах. Понимание данных процессов позволяет разрабатывать новые виды соединений и материалов, а также улучшать существующие технологические процессы.
Благодаря своей реакционной способности, щелочные металлы находят применение в различных отраслях промышленности, включая производство батарей, стекла, щелочей и других химических соединений. Изучение их химии и реакций с солями менее активных металлов позволяет расширить сферу применения и оптимизировать процессы производства различных веществ.
Реакции щелочных металлов с солями
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, проявляют активность в реакциях с солями менее активных металлов. Эти реакции основываются на переносе электронов между атомами металлов и ионами в растворах солей.
В реакции соляной кислоты с щелочными металлами образуется соль и водород. Например, реакция между натрием и соляной кислотой приводит к образованию хлорида натрия и выделению водорода:
2Na + 2HCl → 2NaCl + H2
Соль, образованная в результате реакции, растворяется в воде и образует ионы, которые могут проводить электрический ток. Это делает солевой раствор электролитом, что позволяет использовать эти реакции для проведения электролиза.
Реакции щелочных металлов с солями менее активных металлов также происходят путем переноса электронов. Например, реакция натрия с медной солью приводит к образованию меди и хлорида натрия:
2Na + CuCl2 → Cu + 2NaCl
Эти реакции могут быть использованы в различных промышленных и лабораторных процессах, таких как производство металлов, гальваническое покрытие и синтез химических соединений.
Свойства щелочных металлов:

1) Щелочные металлы – это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются от других металлов своей реактивностью и химическими свойствами.
2) Щелочные металлы обладают малой плотностью и низкой температурой плавления. Они имеют мягкую текстуру и могут быть легко режущими или отделяющимися слоями. Щелочные металлы также являются хорошими проводниками электричества.
3) Щелочные металлы реагируют с водой, образуя газ водород и щелочное растворение. Эта реакция является очень энергичной и может сопровождаться выделением тепла и света. Реактивность щелочных металлов возрастает по мере продвижения по группе от лития к францию.
4) Щелочные металлы образуют соли, в результате реакции с кислотами. Полученные соли часто используются в различных промышленных и лабораторных процессах.
5) Щелочные металлы образуют растворимые гидроксиды, которые являются сильными щелочами и обладают щелочными свойствами. Гидроксиды щелочных металлов используются в промышленности и быту, например, для очистки сточных вод или производства мыла.
6) Щелочные металлы образуют ионы, имеющие положительный заряд, когда они реагируют с другими веществами. Это позволяет им играть важную роль в реакциях и синтезе органических и неорганических соединений.
Химические свойства солей менее активных металлов
Соли менее активных металлов представляют собой химические соединения, образующиеся в результате реакции между ионами менее активного металла и ионами кислоты. В зависимости от химической природы ионов, соли могут обладать различными свойствами и применениями.
Вода растворяет соли менее активных металлов, образуя растворы, которые могут быть безцветными или иметь определенный цвет, зависящий от ионов в растворе. Растворы солей менее активных металлов в целом являются хорошими электролитами, то есть они способны проводить электрический ток в растворе.
Соли менее активных металлов имеют специфические химические реакции. Например, они могут образовывать осадки при взаимодействии с некоторыми другими растворами, например, с растворами солей более активных металлов. Также соли менее активных металлов могут образовывать комплексные соединения с различными лигандами, такими как вода или аммиак, образуя комплексы с определенными свойствами.
Свойства солей менее активных металлов могут варьироваться в зависимости от иона, из которого они образованы. Например, соли калия могут обладать специфическими свойствами, отличными от свойств солей натрия или лития. Как и у любого другого химического соединения, свойства солей менее активных металлов зависят от их химической структуры и атомных взаимодействий внутри молекулы.
Изучение химических свойств солей менее активных металлов важно для понимания их роли в различных химических процессах и реакциях. Это позволяет применять их в различных областях, таких как промышленность, медицина и наука, а также способствует разработке новых материалов и технологий.
Способы взаимодействия щелочных металлов с солями
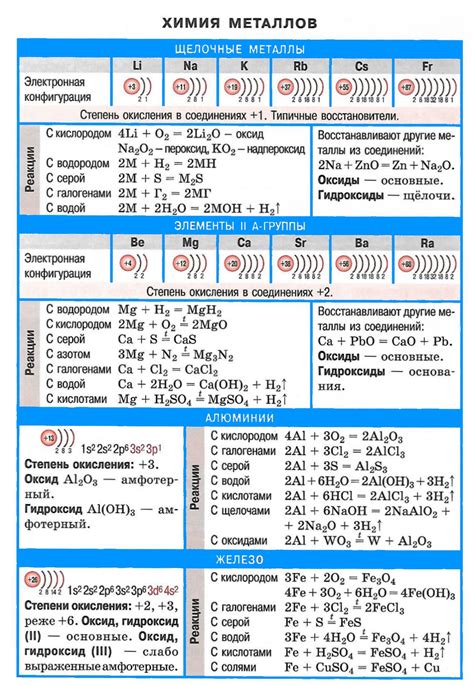
Щелочные металлы, такие как литий, натрий, калий и др., обладают высокой реакционной активностью и способны взаимодействовать с солями менее активных металлов.
Один из способов взаимодействия щелочных металлов с солями заключается в образовании двойных солей. При этом щелочный металл замещает более менее активный металл в соли, образуя новое соединение. Например, атомы натрия могут замещать атомы металла в солях таких металлов, как медь или свинец.
Еще одним способом взаимодействия щелочных металлов с солями является реакция осаждения. При этом щелочный металл реагирует с анионами соли, образуя осадок. Например, когда натрий добавляется в раствор сульфата меди, образуется осадок сульфата натрия и меди.
Также щелочные металлы могут взаимодействовать с солями путем образования гидроксидов. В результате этой реакции образуется щелоча и соответствующая соль. Например, при взаимодействии натрия с нитратом серебра образуется гидроксид натрия и нитрат серебра.
Способы взаимодействия щелочных металлов с солями могут быть различными, в зависимости от конкретных условий и реагентов, однако все они основаны на высокой активности и реакционной способности щелочных металлов.
Реактивность щелочных металлов со солями менее активных металлов
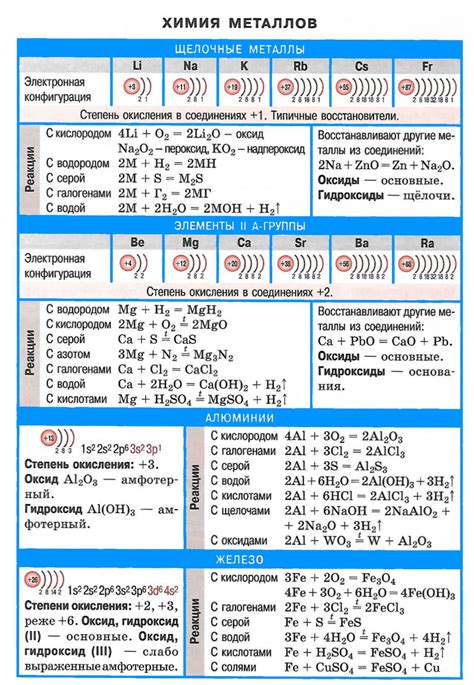
Щелочные металлы, такие как литий, натрий и калий, обладают высокой реактивностью и способностью образовывать соединения с различными элементами. Реакция щелочных металлов с солями менее активных металлов, таких как медь или свинец, является одной из таких химических реакций.
При взаимодействии щелочных металлов с солями менее активных металлов происходит обмен ионами, что приводит к образованию новых соединений. Например, при реакции натрия с солями меди образуется медь и соль натрия.
Реакция между щелочными металлами и солями менее активных металлов часто сопровождается выделением газа и повышенным нагревом. Это связано с энергетической характеристикой реакций данных элементов. Более активные щелочные металлы могут вытеснять менее активные металлы из их солей, что приводит к образованию новых соединений и высвобождению энергии.
Реакция щелочных металлов со солями менее активных металлов имеет широкий спектр применений в различных областях, включая производство металлов, электролитические процессы и чистку металлических поверхностей. Изучение и понимание этих реакций позволяет более полно использовать свойства и возможности химических элементов и соединений для различных целей.
Вопрос-ответ

Какие щелочные металлы существуют и какие реакции они могут проходить с солями менее активных металлов?
Основными щелочными металлами являются литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Щелочные металлы могут проходить реакции с солями менее активных металлов, такие как переходные металлы. Например, они могут образовывать двойные соли, в которых щелочный металл замещает один или несколько ионов менее активного металла в соли. Также щелочные металлы могут образовывать осадки с солями менее активных металлов.
Какие реакции происходят между щелочными металлами и солями менее активных металлов?
Реакции между щелочными металлами и солями менее активных металлов могут быть разнообразными. Например, щелочные металлы могут образовывать двойные соли, такие как хлориды, бромиды, йодиды и т.д. В этом случае щелочный металл замещает один или несколько ионов менее активного металла в соли. Также щелочные металлы могут образовывать осадки с солями менее активных металлов, что может быть использовано в аналитической химии для определения концентрации ионов в растворе.
В чем применение реакций щелочных металлов с солями менее активных металлов в химической промышленности?
Реакции щелочных металлов с солями менее активных металлов имеют некоторое применение в химической промышленности. Например, получение соды при помощи Сода-л", получение карбида кальция из гидрокарбата кальция, а также процессы криолитового электролиза для получения алюминия и магния. Также щелочные металлы используются в производстве стекла и мыла.
