Щелочные металлы, такие как литий, натрий, калий и другие, известны своей низкой температурой плавления. Вопрос о том, почему их температуры плавления так низки, является одним из ключевых в области научных исследований. Этот феномен объясняется особыми свойствами атомов щелочных металлов.
Атомы щелочных металлов имеют один валентный электрон, который находится в самой внешней энергетической оболочке. Такое расположение электрона делает атомы щелочных металлов очень реактивными и способными образовывать ионы с положительным зарядом. При повышении температуры эти ионы начинают быстро двигаться, что приводит к нарушению структуры кристаллической решетки и, в конечном итоге, к плавлению металла.
Еще одной причиной низких температур плавления щелочных металлов является их неполярная химическая связь. Атомы щелочных металлов обладают небольшими электроотрицательностями, что делает их атомы слабыми акцепторами электронов. В результате, межатомные связи в металлической решетке оказываются слабыми, что облегчает плавление.
Щелочные металлы: секрет их низких температур плавления

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, известны своими очень низкими температурами плавления. Это удивительное свойство объясняется особым внутренним строением атомов щелочных металлов.
В атоме щелочного металла на внешнем энергетическом уровне находится всего один электрон. Этот электрон слабо привязан к атому и легко может двигаться между атомами. Такая свободность электрона позволяет атомам щелочных металлов образовывать между собой магазинные связи.
Магазинные связи - это взаимодействие между атомами, при котором электроны движутся свободно между атомами и создают сеть электронных облаков. Это дает щелочным металлам необычные свойства, такие как низкая температура плавления.
Низкая температура плавления связана с тем, что электроны в магазинных связях создают сильные отталкивающие силы между атомами. Это делает сложным изменение положения атомов в кристаллической решетке и, следовательно, требует высоких энергий для плавления металла.
Таким образом, особое внутреннее строение атомов щелочных металлов и образование магазинных связей между ними обуславливают низкие температуры плавления. Это делает щелочные металлы уникальными и полезными в различных областях, включая применение в акумуляторах, легких конструкциях и каталитических процессах.
Что такое щелочные металлы?
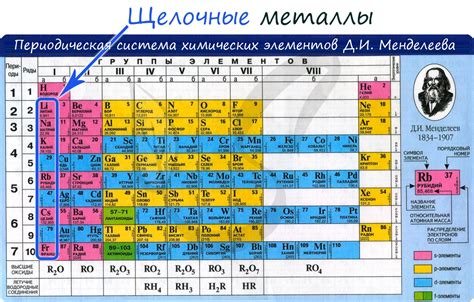
Щелочные металлы - это элементы, которые принадлежат к первой группе периодической таблицы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Щелочные металлы обладают рядом общих характеристик. Они очень реактивны и активно взаимодействуют с водой и кислородом. Обычно они имеют низкую плотность, низкую температуру плавления и кипения, а также мягкую текстуру.
Эти металлы имеют один электрон во внешней электронной оболочке, что делает их очень реактивными и способными легко отдавать этот электрон. Это облегчает их взаимодействие с другими элементами и соединениями.
Щелочные металлы широко используются в различных областях, включая производство стекла, лекарств и синтез органических соединений. Они также играют важную роль в биологии и медицине, где многие из них являются необходимыми микроэлементами для поддержания здоровья человека.
Какие особенности определяют низкую температуру плавления щелочных металлов?
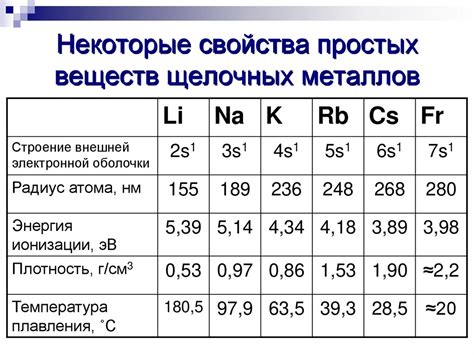
1. Строение атомов
Одной из основных причин низкой температуры плавления щелочных металлов является их особенное строение атомов. Атомы щелочных металлов имеют один электрон в валентной оболочке, что делает их более реакционноспособными. Это приводит к образованию сильной межатомной связи, но в то же время делает их более легкими для разрушения и плавления.
2. Сильная межатомная связь
Валентный электрон в атоме щелочного металла находится на большом расстоянии от ядра и слабо притягивается к нему. Из-за этого происходит образование слабой связи соседних атомов, что приводит к слабому взаимодействию между атомами в галогенидах щелочных металлов. Это делает металлы более подверженными тепловым колебаниям и позволяет им легко плавиться при низкой температуре.
3. Размер и форма атомов
Атомы щелочных металлов имеют большие радиусы и сферическую форму. Благодаря этому они имеют высокий объем и низкую плотность. Большой радиус атома также позволяет атомам более свободно двигаться и менять свою позицию в кристаллической решетке, что способствует плавлению при низкой температуре.
4. Мощные межметаллические связи
Щелочные металлы образуют сильные межметаллические связи, которые способствуют образованию структуры и стабильности их кристаллической решетки. В результате этого связи между атомами щелочных металлов оказываются крепкими и требуют большей энергии для разрушения, что ведет к повышению температуры плавления.
5. Ионная природа химической связи
Связь между атомами щелочных металлов является ионной, а не ковалентной. Это означает, что в процессе плавления атомы щелочных металлов становятся ионами и двигаются свободно в положительных ионных кристаллических решетках. Ионизация атомов при повышении температуры требует большой энергии, которая увеличивает температуру плавления. Однако, благодаря слабости межатомной связи и большим размерам атомов, ионная природа связи оказывается недостаточно сильной для повышения температуры плавления щелочных металлов.
Влияние внешних условий на температуру плавления щелочных металлов
Щелочные металлы - это группа элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они являются самыми реактивными металлами в периодической таблице. Одной из особенностей этих металлов является низкая температура плавления.
Влияние внешних условий, таких как давление и наличие оксидов, на температуру плавления щелочных металлов достаточно велико. Например, давление может значительно повысить температуру плавления щелочных металлов. Это связано с изменением взаимной координации атомов в кристаллической решетке металлов под воздействием давления.
Оксиды щелочных металлов также влияют на температуру плавления. Они формируют нерастворимые соединения с металлами, что препятствует их плавлению. Такие соединения, как оксиды и пероксиды, имеют высокие температуры плавления, что делает щелочные металлы менее реактивными и стабильными при повышенных температурах.
Более высокая масса атома также может повлиять на температуру плавления. Например, цезий имеет наибольшую массу атома среди щелочных металлов, и его температура плавления самая низкая. Это объясняется сильными атомными связями между атомами цезия, которые не так легко нарушить и достичь плавления.
Таким образом, внешние условия, такие как давление и наличие оксидов, а также масса атома, играют важную роль в определении температуры плавления щелочных металлов. Понимание этих факторов позволяет более глубоко изучить свойства и поведение этих металлов в различных условиях.
Роль электронной структуры в образовании низких температур плавления щелочных металлов

Низкая температура плавления щелочных металлов, таких как литий (Li), натрий (Na), калий (K) и другие, является результатом их особой электронной структуры. Щелочные металлы отличаются наличием одной валентной электрона во внешней оболочке, что является основной причиной их химической активности и нестабильности.
Именно этот свободный электрон ответственен за низкую температуру плавления щелочных металлов. Валентный электрон образует "облако" электронов, расположенных вокруг атомного ядра, и это оказывает значительное влияние на физические свойства металлов.
Облако электронов щелочных металлов обладает высокими электронными плотностями, что приводит к образованию сильных кулоновских отталкивающих сил между атомами. Это объясняет низкую температуру плавления данных металлов.
Также, в связи с наличием лишь одного валентного электрона, энергетическая зона "заполнена" только на половину, что делает электроны подвижными и способными свободно перемещаться в кристаллической решетке. Это обуславливает высокую проводимость щелочных металлов и их способность выдерживать высокую токовую нагрузку.
Таким образом, электронная структура щелочных металлов является основным фактором, обуславливающим низкие температуры плавления. Валентный электрон и его особенности формируют характерные физические свойства этих металлов, такие как низкая температура плавления, высокая электропроводность и другие.
Применение щелочных металлов в различных отраслях промышленности
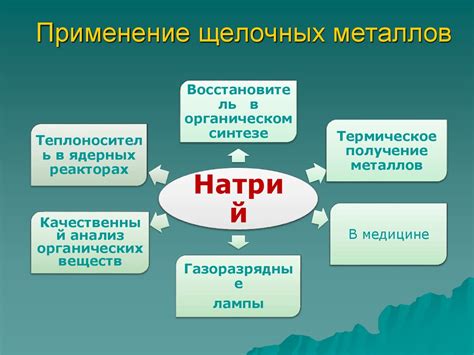
Щелочные металлы, такие как литий, натрий и калий, имеют широкое применение в различных отраслях промышленности благодаря своим уникальным химическим свойствам.
Одной из важных областей, где используются щелочные металлы, является производство батарей и аккумуляторов. Литий-ионные аккумуляторы, содержащие литий, обладают высокой энергетической плотностью и длительным сроком службы, что делает их идеальными для использования в мобильных устройствах, электромобилях и других устройствах, где требуется компактная и надежная энергия.
Еще одной отраслью, где щелочные металлы широко применяются, является химическая промышленность. Калий и натрий используются в производстве различных химических соединений, таких как гидроксиды и сульфаты. Калийные соединения находят применение в сельском хозяйстве, как удобрения для повышения плодородия почвы, а также в производстве стекла, мыла и многих других продуктов.
Помимо этого, щелочные металлы широко используются в промышленности стекла и керамики. Натрий является одним из основных компонентов стекла, обеспечивая ему прозрачность и химическую стабильность. Калий также используется в производстве различных керамических изделий, таких как посуда, плитка и другие строительные материалы.
Cochut.ru
Вопрос-ответ

Какие металлы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Почему температуры плавления щелочных металлов так низки?
Температуры плавления щелочных металлов так низки из-за их особенной электронной структуры. У них всего один электрон на внешнем энергетическом уровне, что делает электронный газ очень подвижным и легко охлаждаемым, что приводит к низким значениям температур плавления.
Как электронная структура влияет на температуру плавления щелочных металлов?
Электронная структура щелочных металлов, с одним электроном в валентной оболочке, делает электронный газ очень подвижным и легко охлаждаемым. Это приводит к низким значениям температур плавления щелочных металлов.
Чем еще является фактором, определяющим низкую температуру плавления щелочных металлов?
Одним из основных факторов, определяющих низкую температуру плавления щелочных металлов, является сильное электроотрицательное влияние ядра на электроны, что приводит к слабому взаимодействию между атомами металла и низкому энергетическому барьеру на пути к плавлению.
Какие еще свойства имеют щелочные металлы?
Щелочные металлы обладают рядом других характеристик, таких как высокая реакционная способность, низкая плотность, хорошая электрическая и теплопроводность, низкая твердость и низкая точка кипения.
