Щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), известны своей склонностью к реакции с водой. При контакте с водой, эти металлы образуют гидроксиды и высвобождают водород. Эта реакция является экзотермической, то есть сопровождается выделением тепла.
Однако, существует различие в скорости реакции щелочных металлов с водой. Литий, самый легкий щелочный металл, является наиболее активным и реагирует с водой самым быстрым образом. Натрий, со следующим атомным номером, реагирует менее активно, а калий наиболее медленно соприкасается с водой.
При реакции щелочных металлов с водой образуется гидроксид металла и высвобождается водород. В реакции с литием образуется литийгидроксид (LiOH) и высвобождается водород газ (H2). С натрием образуется натрийгидроксид (NaOH) и также выделяется водород, а с калием образуется калиевый гидроксид (KOH) и водород.
Реакция щелочных металлов с водой является важным процессом и находит свое применение в различных отраслях промышленности, таких как производство щелочей, производство водорода и использование гидроксидов в пищевой и фармацевтической промышленности. Выбирая правильное утверждение о реакции щелочных металлов с водой при комнатной температуре, необходимо учесть различие в активности металлов и образование соответствующих гидроксидов.
Реакция щелочных металлов с водой

Щелочные металлы (натрий, калий, рубидий, цезий и франций) относятся к элементам первой группы периодической системы. Они проявляют уникальные свойства при реакции с водой.
Реакция щелочных металлов с водой происходит с образованием гидроксида металла и выделением водорода. При этом происходит активное разложение воды на ионы водорода и гидроксидные ионы. Реакция является экзотермической и сопровождается выделением тепла.
Щелочные металлы реагируют с водой достаточно быстро. Они имеют низкую ионизационную энергию, что обуславливает их высокую активность. Взаимодействие металла с водой происходит по следующей реакции:
2M + 2H2O → 2MOH + H2↑
Гидроксид металла (МОН) образует щелочные растворы, обладающие щелочными свойствами. Они обладают высокой щелочностью и хорошо растворимы в воде.
При проведении реакции с водой рекомендуется следовать мерам предосторожности, так как при этом происходит выделение горючего водорода, а также возможны брызги щелочного раствора.
Таблица ниже показывает химические уравнения реакции щелочных металлов с водой:
| Металл | Химическое уравнение реакции |
|---|---|
| Натрий | 2Na + 2H2O → 2NaOH + H2↑ |
| Калий | 2K + 2H2O → 2KOH + H2↑ |
| Рубидий | 2Rb + 2H2O → 2RbOH + H2↑ |
| Цезий | 2Cs + 2H2O → 2CsOH + H2↑ |
| Франций | 2Fr + 2H2O → 2FrOH + H2↑ |
В результате реакции щелочных металлов с водой образуются щелочные растворы, которые находят широкое применение в различных областях науки и промышленности.
Свойства щелочных металлов

Щелочные металлы – это группа элементов периодической системы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Изучение их свойств имеет важное значение в химии, так как эти металлы являются не только активными, но и самыми легкими металлами.
Одно из основных свойств щелочных металлов – их активность при реакции с водой. При контакте с водой щелочные металлы образуют щелочные растворы и выделяются водород. Реакция с водой происходит с выделением большого количества тепла и образованием щелочных гидроксидов. Например, реакция натрия с водой представляется уравнением:
2Na + 2H₂O → 2NaOH + H₂↑
Щелочные металлы также обладают низким плотностью, что делает их легкими и хорошо плавающими на воде. Они обладают мягкостью и низкой твердостью, поэтому легко режутся ножом, а металлический блеск их поверхности быстро тускнеет под воздействием воздуха.
Другим характерным свойством щелочных металлов является их активность в реакции с кислородом. При контакте с воздухом щелочные металлы начинают активно окисляться, образуя оксиды или пероксиды. Например, натрий при реакции с кислородом образует оксид натрия:
4Na + O₂ → 2Na₂O
Таким образом, щелочные металлы проявляют не только активность при взаимодействии с водой, но и с другими химическими элементами, что является одним из их основных свойств.
Классификация щелочных металлов
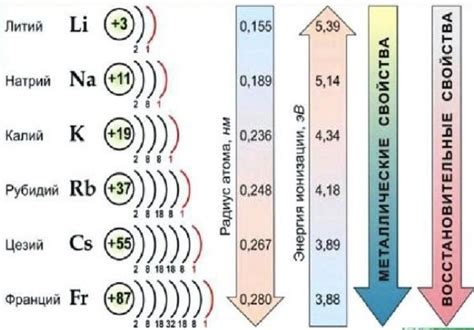
Щелочные металлы, также известные как первая группа элементов, включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются самыми активными металлами в периодической системе химических элементов и обладают рядом общих химических свойств.
Щелочные металлы образуют катионы с однозарядными ионами, что делает их очень реактивными в химических реакциях. Они имеют низкую плотность и мягкость, а также низкую температуру плавления и кипения.
Литий является самым легким из щелочных металлов и обладает наименьшей активностью. В то же время, франций является самым тяжелым и наиболее реактивным в этой группе.
Помимо общих свойств, щелочные металлы также имеют индивидуальные химические характеристики. Например, литий используется в производстве аккумуляторов, натрий применяется в пищевой промышленности, а калий необходим для поддержания нормального функционирования организма человека.
В таблице ниже представлена классификация щелочных металлов по их атомным номерам, относительной атомной массе и плотности:
| Элемент | Атомный номер | Относительная атомная масса | Плотность (г/см³) |
|---|---|---|---|
| Литий | 3 | 6.941 | 0.534 |
| Натрий | 11 | 22.99 | 0.971 |
| Калий | 19 | 39.098 | 0.856 |
| Рубидий | 37 | 85.468 | 1.532 |
| Цезий | 55 | 132.91 | 1.93 |
| Франций | 87 | 223 | 1.87 |
Классификация щелочных металлов позволяет лучше понять их общие и индивидуальные свойства, а также применение в различных областях науки и промышленности.
Щелочные металлы и их активность

Щелочные металлы – это элементы, относящиеся к первой группе периодической системы. В данной группе находятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают высокой реакционной способностью, особенно при взаимодействии с водой при комнатной температуре.
Каждый из щелочных металлов обладает своей степенью активности, которая определяется их возможностью взаимодействовать с веществами. Натрий и калий являются самыми активными щелочными металлами, а литий – наименее активным. Франций, хотя и является самым реактивным из всех щелочных металлов, очень редко встречается в природе, так как является радиоактивным и имеет очень короткий период полураспада.
Реакция щелочных металлов с водой при комнатной температуре происходит с выделением водорода и образованием гидроксидов. При этом наблюдается резкое возгорание щелочных металлов, так как реакция идет с большим выделением тепла. Самым ярким примером этой реакции является взаимодействие калия с водой, которое сопровождается хлопком и образованием огненного шара.
Реакция щелочных металлов с водой происходит с увеличением pH воды и образованием щелочных растворов. Гидроксиды щелочных металлов являются сильными основаниями и обладают высокой растворимостью в воде. Эти растворы обладают щелочной реакцией, вызывают жжение и раздражение кожи и слизистых оболочек.
Сравнение реакции щелочных металлов с водой
Реакция щелочных металлов с водой при комнатной температуре – это процесс, в результате которого происходит образование щелочной соли и выделение водорода. Щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), реагируют с водой, образуя основание.
Реакция щелочных металлов с водой протекает быстро и является самоокислительно-восстановительной. В процессе реакции щелочный металл окисляется, а вода восстанавливается. Этот процесс сопровождается выделением водорода газа, который можно наблюдать в виде пузырьков на поверхности воды.
Сравнивая реакцию различных щелочных металлов с водой, можно отметить, что скорость реакции и интенсивность выделения водорода зависят от электрохимических свойств металла. Например, литий реагирует с водой наиболее активно – плавающий металл мгновенно загорается и движется по поверхности воды. Натрий и калий также реагируют с водой достаточно быстро и интенсивно, но уже без "подрыва" и пламени.
Однако следует отметить, что протекание реакции щелочных металлов с водой может быть нарушено, если на воде образуется слой окиси металла или на поверхности металла появляется пленка серы или окиси. В таком случае реакция может протекать не так активно или вообще остановиться.
Физические и химические характеристики реакции

Реакция щелочных металлов с водой при комнатной температуре является химическим процессом, в котором взаимодействуют вода и щелочные металлы, такие как литий, натрий, калий.
Основная физическая характеристика данной реакции - образование водорода. При контакте щелочного металла с водой происходит ионный обмен между металлом и водой, при этом вода распадается на водород и гидроксид щелочного металла.
Реакция щелочных металлов с водой является эндотермической, то есть сопровождается поглощением тепла из окружающей среды. При этом температура реагентов может повышаться, а в реакцию могут включаться дополнительные реагенты, например, ангидроусольняющие вещества.
Химическая характеристика реакции щелочных металлов с водой заключается в образовании гидроксидов щелочных металлов и освобождении водорода. В результате реакции образуются сильные основания, такие как гидроксиды лития, натрия или калия.
Для успешной протекания реакции необходимо наличие воды, так как она является основной составляющей реагентов. Кроме того, реакция может протекать только с активными металлами, так как требуется возможность образования ионов.
Выбор правильного утверждения

Щелочные металлы реагируют с водой при комнатной температуре, образуя гидроксиды и выбрашивая водород. Эта реакция происходит со всеми щелочными металлами, такими как натрий, калий и литий.
Правильное утверждение: Реакция щелочных металлов с водой при комнатной температуре является эндотермической. При контакте щелочного металла с водой происходит поглощение тепла из окружающей среды, что обуславливает охлаждение образовавшегося гидроксида и появление пузырьков водорода. Эндотермическая реакция означает, что энергия поглощается системой.
Количество выделяемого водорода зависит от массы использованного щелочного металла и его расположения в ряду активности металлов. Натрий, который находится ниже в ряду, будет более активным и образует более реакционную смесь с водой, чем калий или литий.
В результате реакции между щелочным металлом и водой образуется гидроксид щелочного металла, который растворяется в воде. Образующийся водород является горючим газом и может быть использован в качестве топлива или для других химических процессов. Однако такие реакции с щелочными металлами требуют аккуратности и контроля, так как они могут быть сопряжены с риском возгорания или даже взрыва.
Практическое применение реакции

Реакция щелочных металлов с водой при комнатной температуре имеет широкое практическое применение в различных областях науки и техники.
Одним из основных применений этой реакции является получение водорода. При взаимодействии щелочных металлов с водой возникает выделение газообразного водорода, который может использоваться в различных процессах и технологиях. Водород служит как источник энергии для горючих элементов топливных ячеек, так и сырье для производства различных химических веществ.
Кроме того, реакция щелочных металлов с водой может применяться в качестве метода очистки от отходов и загрязнений. Щелочные металлы имеют способность реагировать с различными загрязнителями, образуя стабильные соединения. Таким образом, реакция с водой может служить для удаления опасных и токсичных веществ из отходов или загрязненных водных растворов.
Другим применением реакции является синтез различных соединений щелочных металлов. В результате взаимодействия с водой образуются гидроксиды щелочных металлов, которые могут быть использованы в качестве катализаторов, ионных обменников, а также в производстве стекла, мыла и других химических продуктов.
Вопрос-ответ

Какие щелочные металлы реагируют с водой при комнатной температуре?
Щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), реагируют с водой при комнатной температуре.
Что происходит при реакции щелочных металлов с водой?
При реакции щелочных металлов с водой образуется гидроксид металла и выделяется водородный газ.
