В химии существует общий принцип, гласящий, что все соли металлов растворимы. Это значит, что все соединения, образованные щелочными и щелочноземельными металлами, могут растворяться в воде или других растворителях. Однако, при этом существуют некоторые особенности, связанные с растворимостью щелочных металлов.
Щелочные металлы – это элементы, которые находятся в первой группе периодической системы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы характеризуются низкой плотностью, низкой температурой плавления и высокой химической активностью. Они имеют всего один электрон во внешней энергетической оболочке, что делает их легко потеряемыми при образовании ионов.
Вода играет важную роль в растворении солей щелочных металлов. Это связано с тем, что вода является полярным растворителем, а ионы щелочных металлов обладают положительным зарядом. В процессе растворения, положительные ионы находятся в присутствии водных молекул, которые их окружают и увлекают с собой. Это объясняет, почему соли щелочных металлов легко растворяются в воде и образуют проводящий ионный раствор.
Влияние солей металлов на растворимость
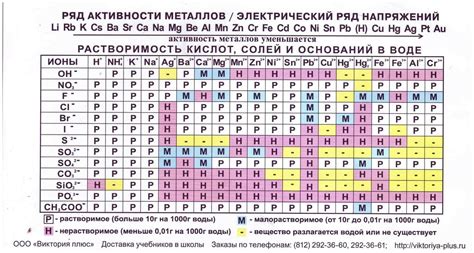
Растворимость солей металлов является одним из важнейших свойств, определяющих их химические свойства. Растворимость солей зависит от множества факторов, включая природу металла, его заряд и размер ионов, а также природу аниона. Соли металлов, в частности щелочных металлов, обладают высокой растворимостью в воде.
Особенностью щелочных металлов является то, что все их соли являются водорастворимыми. Это связано с тем, что ионы щелочных металлов обладают большим радиусом и низкой зарядностью, что позволяет им образовывать сильные и стабильные ионные связи с анионами. Большой радиус ионов также облегчает образование гидратной оболочки и обеспечивает хорошую сольватацию ионов в растворе.
Влияние солей металлов на растворимость может быть связано также с наличием или отсутствием осадка. Например, соли металлов с некоторыми анионами могут образовывать тугоплавкие осадки, которые не растворяются в воде. Это связано со специфическими химическими свойствами анионов, которые не позволяют образовывать стабильные ионные связи с ионами металла и гидратной оболочкой.
Таким образом, растворимость солей металлов является результатом сложного взаимодействия различных химических факторов. Изучение этих факторов позволяет более глубоко понять химические свойства солей металлов и их влияние на окружающую среду и технологические процессы.
Особенности растворимости щелочных металлов
1. Высокая растворимость: Щелочные металлы, такие как литий, натрий, калий и др., обладают высокой степенью растворимости в воде. Это означает, что большинство их солей легко растворяются и образуют ионы в растворе.
2. Образование щелочных растворов: При растворении солей щелочных металлов в воде образуются алкалийные растворы, которые имеют щелочную реакцию. Это связано с высокой концентрацией гидроксидных ионов OH- в растворе.
3. Образование сильных электролитов: Ионы щелочных металлов в растворе обладают сильными электролитическими свойствами, что означает, что они способны проводить электрический ток. Это связано с высокой подвижностью ионов в растворе.
4. Образование осадков: При реакции щелочных металлов с некоторыми кислотными растворами образуются осадки. Например, реакция натрия с хлоридом серебра приводит к образованию нерастворимого хлорида серебра, который выпадает в виде белого осадка.
5. Различная растворимость различных солей: Несмотря на общую высокую растворимость щелочных металлов, соли различных щелочных металлов имеют различную степень растворимости в воде. Например, нитраты и карбонаты щелочных металлов растворяются лучше, чем фосфаты и сульфиды.
Роль солей металлов в химических реакциях
Соли металлов играют важную роль во многих химических реакциях, которые происходят как в природе, так и в промышленности. Они являются необходимыми компонентами для проведения различных процессов и обладают уникальными химическими свойствами.
Первое, с чем сталкиваемся, это растворение солей металлов в воде, что приводит к образованию электролитических растворов. Это связано с тем, что большинство солей металлов обладает ионным характером и способно разделяться на положительно и отрицательно заряженные ионы. Именно эти ионы обладают способностью участвовать в различных реакциях.
Соли металлов широко применяются в синтезе различных химических соединений. Благодаря своей реакционной активности они способны взаимодействовать с другими веществами и превращаться в новые соединения. Добавление солей металлов в реакционную смесь может ускорить или улучшить процесс реакции, а также изменить ее направление.
Соли металлов применяются и в качестве катализаторов химических реакций. Катализаторы - это вещества, которые способны ускорять химическую реакцию, не изменяясамого себя. Большинство солей металлов обладает катализаторными свойствами и находят применение в промышленности, особенно в процессах производства органических соединений и утилизации отходов.
Некоторые соли металлов обладают способностью изменять окраску раствора или твердого вещества при воздействии на них различных факторов, таких как pH, свет, температура и т.д. Это свойство часто используется в химическом анализе и диагностике, а также в процессах окрашивания и красочной промышленности.
В заключение, соли металлов играют важнейшую роль в химических реакциях благодаря своим уникальным свойствам. Они способны растворяться в воде, участвовать в синтезе и катализе, а также изменять цвет в реакционных средах. Без участия солей металлов многие химические процессы были бы невозможны или неэффективны.
Взаимодействие солей металлов с водой

Взаимодействие солей металлов с водой представляет собой химическую реакцию, при которой соль диссоциирует на ионы металла и анионы. Диссоциация происходит в воде, поскольку вода – хороший растворитель.
При контакте с водой, ионы металла образуют гидратные комплексы, что сказывается на свойствах солей. Гидратные комплексы обладают высокой устойчивостью и сохраняются при обычных условиях. Это объясняет прозрачность большинства водных растворов солей металлов.
Некоторые соли металлов могут проявлять различные физические свойства при взаимодействии с водой. Например, хлорид натрия растворяется в воде при понижении температуры, и его раствор становится замерзающим. При этом концентрация соли в растворе возрастает, так как процесс протекает с образованием ледяной решетки, накапливающей соль.
Взаимодействие солей металлов с водой может сопровождаться поглощением или выделением тепла. Это связано с кинетическими особенностями реакции, где происходит образование или разрушение связей. Также некоторые соли металлов могут выделять газы в процессе взаимодействия с водой, такие как аммиак, сероводород или углекислый газ.
Электролитическое диссоцирование солей металлов

Электролитическое диссоцирование – это процесс разделения ионов в растворе солей под воздействием электрического тока. В случае с солями металлов, это означает, что соли распадаются на положительно заряженные ионы металла и отрицательно заряженные ионы, обычно анорганические кислоты или основания.
Электролитическое диссоцирование происходит в электролитической ячейке, которая состоит из двух электродов – анода и катода – погруженных в раствор соли. Под воздействием электрического тока на электродах происходят окислительно-восстановительные реакции, которые приводят к образованию ионов металла на одном из электродов и ионов основания или кислоты на другом.
В результате электролитического диссоцирования образуется раствор, содержащий ионы металла и ионы основания или кислоты. Ионы металла, имеющие положительный заряд, находятся в растворе, а ионы основания или кислоты, имеющие отрицательный заряд, соединяются друг с другом и образуют нерастворимые соли или осадок.
Таким образом, электролитическое диссоцирование солей металлов позволяет получить растворы, содержащие положительно заряженные ионы металла, которые имеют широкое применение в различных областях, таких как химическая промышленность, металлургия, медицина и другие.
Влияние pH на растворимость солей металлов
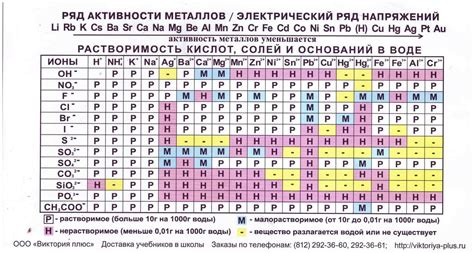
Растворимость солей металлов является важным свойством, определяющим их поведение в химических реакциях. pH окружающей среды оказывает существенное влияние на растворимость этих соединений.
Вода и многие растворы имеют определенную кислотно-щелочную реакцию, выраженную через показатель pH. При нейтральном pH (около 7) большинство солей металлов хорошо растворяется. Однако при изменении pH, растворимость солей также может изменяться.
Для щелочных металлов, таких как натрий (Na), калий (K), растворимость их солей в воде достаточно высока в широком диапазоне pH. Это связано с тем, что щелочные металлы образуют гидроксиды, которые хорошо растворяются и образуют щелочные растворы.
Однако для некоторых металлов, включая алюминий (Al), железо (Fe) и медь (Cu), растворимость их солей может сильно зависеть от pH среды. Например, гидроксид алюминия плохо растворим в нейтральных условиях, но при повышении pH становится легко растворимым.
Изучение растворимости солей металлов в зависимости от pH является важной задачей химии и имеет практическое значение при проведении различных химических процессов, включая производство и очистку различных веществ.
Факторы, влияющие на растворимость солей металлов

1. Температура
Температура является одним из главных факторов, влияющих на растворимость солей металлов. Обычно, при повышении температуры растворимость солей увеличивается, а при понижении - уменьшается. Впрочем, есть исключения, например, соли некоторых металлов, таких как серебро и медь, растворяются лучше при низких температурах.
2. Растворитель
Растворитель также оказывает влияние на растворимость солей металлов. Некоторые соли растворяются легко в одних растворителях, но практически не растворяются в других. Например, соли щелочных металлов, таких как натрий и калий, обычно легко растворяются в воде, но практически не растворяются в органических растворителях.
3. Размер и заряд ионов
Размер и заряд ионов также влияют на растворимость солей металлов. В целом, соли с маленькими ионами имеют большую растворимость, чем соли с большими ионами. Кроме того, соли с зарядом, берущим участие в образовании ионного кристалла, могут быть растворены только другими ионами с аналогичным зарядом.
4. Природа металла
Природа металла также оказывает влияние на его растворимость в соли. У разных металлов могут быть различные свойства, способствующие или препятствующие их растворению. Например, металлы, обладающие низкой степенью активности, такие как золото и платина, редко образуют растворы с другими солями, в то время как металлы с высокой степенью активности, такие как натрий и калий, легко образуют растворы.
5. Взаимодействие с другими веществами
Взаимодействие с другими веществами, находящимися в растворе, также может влиять на растворимость солей металлов. Некоторые растворители или добавки могут способствовать растворению определенных металлов, в то время как другие могут затруднять или препятствовать этому процессу.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий, калий и рубидий, являются важными компонентами в различных отраслях промышленности. Их уникальные свойства и способность образовывать растворы помогают решать различные задачи.
Одним из наиболее распространенных применений щелочных металлов является производство щелочей и щелочных растворов, которые широко используются как отжигающие и расщепляющие агенты в металлургической, химической и горнодобывающей промышленности. Эти растворы также используются в процессе производства бумаги, стекла, мыла, моющих средств и других продуктов.
Еще одним важным применением щелочных металлов является их использование в производстве батарей. Литий-ионные аккумуляторы, которые являются основными источниками питания для мобильных устройств и электромобилей, содержат литий и натрий. Кроме того, щелочные батареи, содержащие калий и никель, широко используются в бытовых приборах и электронике.
Щелочные металлы также находят применение в производстве стекла. Добавление натрия и калия в стекольную смесь позволяет улучшить его химическую стойкость, прозрачность и термическую устойчивость. Благодаря этим свойствам, стекло с щелочными добавками используется в окнах, солнцезащитных очках, лабораторных приспособлениях и других изделиях.
В промышленности также широко используется поташ - калийная соль, которая получается из пепла растений, обогащенных калием. Поташ используется в производстве удобрений, стекла, мыла, алюминия и других продуктов. Он также служит сырьем для производства щелочи, глизерина и других химических веществ.
Биологическая значимость солей металлов
Соли металлов играют важную роль в биологических системах. Они выполняют разнообразные функции, необходимые для нормального функционирования организма. Одной из важнейших функций является участие солей металлов в биохимических реакциях.
Некоторые соли металлов, такие как калий и натрий, участвуют в поддержании осмотического давления клеток. Они помогают регулировать баланс воды и электролитов в организме. Калий, например, необходим для правильной работы сердечной мышцы и нервной системы.
Другие соли металлов, включая кальций и магний, играют ключевую роль в поддержании здоровья костей и зубов. Кальций также участвует в передаче нервных импульсов и сокращении мышц. Магний нужен для активации более 300 ферментов, которые участвуют в различных реакциях организма.
Соли железа входят в состав гемоглобина - вещества, несущего кислород по крови. Железо также необходимо для синтеза многих белков и ферментов. Оно играет роль в иммунной системе, участвуя в борьбе с инфекциями.
Однако необходимо отметить, что при избыточном или недостаточном употреблении солей металлов в организме могут возникать различные проблемы со здоровьем. Поэтому важно поддерживать баланс и употреблять необходимое количество солей металлов, следуя принципам здорового питания.
Вопрос-ответ

Какие металлы относятся к щелочным?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Почему все соли щелочных металлов растворимы?
Соли щелочных металлов растворяются в воде благодаря взаимодействию катионов щелочного металла с анионами воды, образуя гидраты.
Какую роль играет растворимость солей щелочных металлов в живых организмах?
Растворимость солей щелочных металлов в живых организмах играет важную роль, так как эти соли являются необходимыми микроэлементами для поддержания нормального функционирования организма.
Какие свойства имеют щелочные металлы?
Щелочные металлы обладают такими свойствами, как низкая плотность, низкая температура плавления и высокая активность. Они хорошо реагируют с водой, образуя щелочные растворы и высвобождая водород.
Какие ещё примеры растворимости солей щелочных металлов встречаются в повседневной жизни?
Примерами растворимости солей щелочных металлов в повседневной жизни являются использование поваренной соли (хлорида натрия) в кулинарии, использование гипохлорита натрия в домашней химии и добавление калия в удобрения для растений.
