Щелочные металлы представляют собой группу химических элементов, которые находятся в первой группе периодической системы. В эту группу входят литий, натрий, калий, рубидий, цезий и франций. Их отличительными особенностями являются низкая плотность, низкая температура плавления, высокая реактивность и амфотерное поведение.
Литий является самым легким металлом и химически активным элементом. Он обладает наименьшей плотностью среди щелочных металлов и имеет наиболее низкую температуру плавления. Литий широко используется в производстве легких аккумуляторов, в ядерной энергетике и в производстве лекарственных препаратов.
Натрий является вторым по активности щелочным металлом и обладает хорошей проводимостью тепла и электричества. Он находит широкое применение в производстве стекла, щелочей, косметики и пищевых продуктов.
Калий является наиболее распространенным щелочным металлом, встречающимся в природе. Он играет важную роль в жизнедеятельности растений и является необходимым элементом для их роста и развития. Калий также применяется в производстве удобрений, стекла и щелочей.
Важно сказать, что щелочные металлы обладают высокой реактивностью и должны храниться под слоем керосина или масла для предотвращения реакции с кислородом воздуха.
Рубидий, цезий и франций - редкие металлы, которые обладают слабой проводимостью тепла и электричества. Они находят ограниченное применение в научных исследованиях, электронике и в производстве оптических приборов.
В заключение, щелочные металлы представляют собой важную группу химических элементов, которые широко используются в различных областях промышленности и науки.
Определение и свойства щелочных металлов
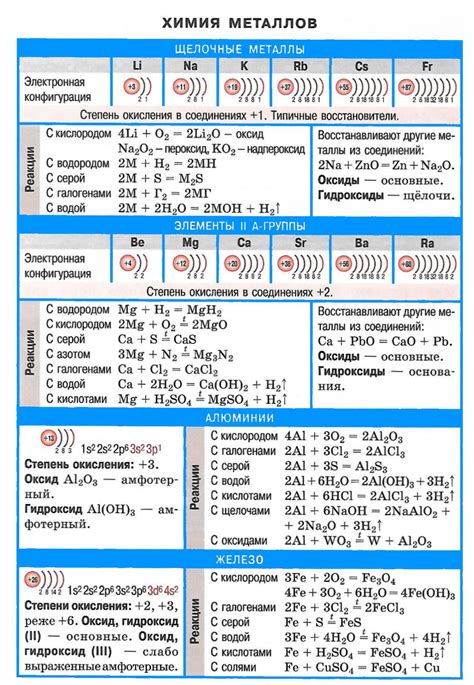
Щелочные металлы представляют собой группу элементов, которые относятся к первой группе периодической таблицы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются от других элементов благодаря своим химическим и физическим свойствам.
Одним из основных свойств щелочных металлов является их высокая реактивность. Они активно взаимодействуют с водой, выделяя водородный газ и образуя щелочные растворы. Это свойство делает их полезными в различных областях, таких как производство батарей, лекарств и пищевой промышленности.
Щелочные металлы также являются хорошими проводниками электричества и тепла. Они обладают низкой плотностью и низкой температурой плавления, что делает их популярными материалами для создания легких сплавов.
Щелочные металлы характеризуются также наличием одной внешней электронной оболочки, что делает их легко ионизируемыми. Они образуют однозарядные положительные ионы при потере этой электронной оболочки. Это свойство позволяет использовать щелочные металлы в различных химических реакциях.
- Литий (Li) - легкий металл, используется в производстве аккумуляторов и лекарств.
- Натрий (Na) - основной компонент пищевых солей, используется в пищевой промышленности и в производстве соды.
- Калий (K) - необходим для регулирования водного баланса в организме, используется в сельском хозяйстве и производстве удобрений.
- Рубидий (Rb) - используется в научных исследованиях и в электронике.
- Цезий (Cs) - имеет широкое применение в ядерной энергетике и в научных исследованиях.
- Франций (Fr) - самый редкий и наиболее реактивный щелочный металл, его применение ограничено из-за его высокой реактивности и короткого периода полураспада.
Все эти свойства делают щелочные металлы важными и широко используемыми элементами в нашей повседневной жизни.
Физические свойства щелочных металлов

Щелочные металлы – это группа элементов, включающая литий, натрий, калий, рубидий, цезий и франций. У этих металлов есть несколько характерных физических свойств, которые отличают их от других элементов.
Во-первых, щелочные металлы являются очень мягкими. Они мягче практически всех других металлов. Например, литий так мягок, что может быть нарезан ножом, а калий можно растереть пальцами. Это связано с их малой твердостью и наличием слабой внутренней структуры.
Во-вторых, щелочные металлы имеют низкую плотность. Они легче большинства других металлов и обладают низкой плотностью по сравнению с многими другими элементами. Например, калий имеет плотность всего около 0,86 г/см³, что делает его одним из самых легких металлов.
В-третьих, щелочные металлы имеют низкую температуру плавления и кипения. Они плавятся при относительно низких температурах и быстро испаряются. Например, натрий плавится при температуре около 98 градусов Цельсия, а кипит при температуре около 893 градусов Цельсия. Это делает их полезными для использования в различных процессах, таких как плавление металлов или изготовление солей.
Кроме того, щелочные металлы являются хорошими проводниками тепла и электричества. Они обладают высокой электропроводностью и теплопроводностью благодаря наличию свободных электронов в их структуре. Это делает их полезными для различных электронных устройств и применений.
В целом, физические свойства щелочных металлов делают их уникальными и важными элементами для различных областей науки и технологий.
Химические свойства щелочных металлов

Щелочные металлы - это группа элементов периодической системы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой химической реактивностью и реактивностью, составляющую ключевую особенность этой группы элементов.
Первое химическое свойство, которое выделяет щелочные металлы, - их способность взаимодействовать с водой. Когда щелочные металлы реагируют с водой, они образуют щелочные растворы и выделяются водород. Это экзотермическая реакция, что означает, что она выделяет тепло. Чем больше атом, тем более реактивным будет металл.
Второе химическое свойство щелочных металлов - их реакция с кислородом. Они реагируют с кислородом подобно металлам переходных элементов, образуя оксиды. Например, натрий образует оксид натрия (Na2O). Реакция с кислородом может происходить с жаром или без него в зависимости от условий.
Третье химическое свойство щелочных металлов - их способность образовывать ионы. Щелочные металлы легко отдают электроны и образуют ионы с положительным зарядом. Например, натрий (Na) может отдать один электрон и образовать ион Na+. Эти положительно заряженные ионы являются основными структурными единицами в щелочных соединениях и играют важную роль в реакциях между щелочными металлами и другими элементами.
Химические свойства щелочных металлов делают их важными в различных областях науки и технологии. Они используются в производстве сплавов, в процессах синтеза органических соединений и в электронике. Благодаря своим уникальным химическим свойствам, щелочные металлы являются неотъемлемой частью нашей современной жизни.
История открытия щелочных металлов

Щелочные металлы – это элементы, которые находятся в первой группе периодической системы. К этой группе относятся литий, натрий, калий, рубидий, цезий и франций. Открытие щелочных металлов связано с историей развития химии и наук о веществах.
Первоначально, многие из этих элементов существовали только в виде соединений, и их чистые металлические формы неизвестны до сих пор. Однако, уже в древние времена, египтяне использовали соду при изготовлении стекла и мыла, а фосфат калия использовался в гноях для удобрения почвы.
Первым щелочным металлом, который был открыт, был калий. В 1807 году химик Хамфри Дэйви исследовал соль, полученную из золы дерева, и изолировал из нее металлическую компоненту. Он назвал этот элемент "калий" в честь арабского слова "ал-кали".
Вскоре после открытия калия были найдены и другие щелочные металлы. В 1817 году Йоханнисон Берцелиус изолировал натрий при помощи электролиза гидроксида натрия. А в 1823 году он также обнаружил литий, используя электролиз раствора лития.
Открытие и изучение щелочных металлов играли важную роль в развитии промышленности и науки. Они нашли применение в различных отраслях, от производства стекла и мыла до использования в химической и фармацевтической промышленности.
Однако, стоит отметить, что вторжение щелочных металлов в воду может привести к реакции, в результате которой выделяется значительное количество энергии. Поэтому, их использование требует особых мер предосторожности и контроля.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, широко применяются в различных отраслях промышленности благодаря своим уникальным свойствам.
Литий – легкий металл с высокой электропроводностью, поэтому он часто используется в производстве аккумуляторов, особенно в разных портативных устройствах. Кроме того, литиевые соединения находят применение в производстве жидкостей для охлаждения ядерных реакторов.
Натрий – один из самых распространенных щелочных металлов. Он используется в производстве стекла, керамики, мыла, хлора и алкоголя. Натрий также применяется в пищевой промышленности как добавка для улучшения вкуса и сохранения продуктов.
Калий является необходимым элементом для растений, поэтому он широко используется как удобрение в сельском хозяйстве. Калийные соединения также применяются в производстве стекла, мыла, моющих средств и в производстве взрывчатых веществ.
Рубидий и цезий используются в оптической промышленности для производства специальных стекол и фоточувствительных элементов. Они также находят применение в научных исследованиях и в производстве ядерных реакторов.
Влияние щелочных металлов на окружающую среду

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют значительное влияние на окружающую среду.
1. Поглощение воды: Щелочные металлы обладают высокой реактивностью и быстро реагируют с водой, что может привести к образованию щелочных растворов. Эти растворы, если попадут в окружающую среду, могут оказывать разрушительное воздействие на экосистемы водных ресурсов.
2. Разрушение почвы: Щелочные металлы могут накапливаться в почве и приводить к ее загрязнению. Это может привести к снижению плодородия почвы, что, в свою очередь, негативно сказывается на сельском хозяйстве и росте растений.
3. Загрязнение атмосферы: Некоторые щелочные металлы, такие как калий и цезий, могут испаряться при повышенных температурах и попадать в атмосферу. Это может приводить к загрязнению воздуха и негативно влиять на здоровье людей и животных.
4. Влияние на биологические системы: Щелочные металлы могут оказывать токсическое воздействие на живые организмы. Они могут накапливаться в тканях животных и вызывать нарушение метаболических процессов. Кроме того, отдельные щелочные металлы могут вступать в химические реакции с белками и нуклеиновыми кислотами, что может привести к повреждению клеток.
5. Отходы производства: Производство и использование щелочных металлов также сопровождаются образованием отходов, которые могут содержать опасные для окружающей среды вещества. Распространение и неправильная утилизация этих отходов может вызвать загрязнение почвы, воды и атмосферы.
В целом, влияние щелочных металлов на окружающую среду является значительным и требует внимания со стороны социальных и экологических организаций, а также производителей и потребителей щелочных металлов.
Реакции щелочных металлов с водой и кислородом
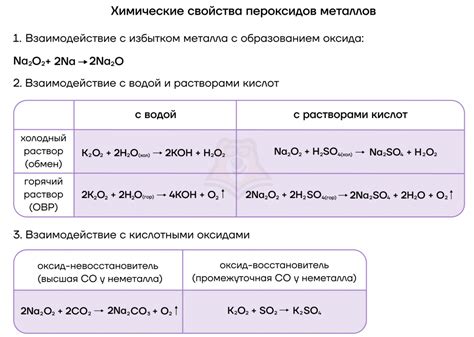
Щелочные металлы - это группа элементов периодической системы, которые включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой химической реакционностью и образуют ряд интересных веществ.
Одной из наиболее известных реакций щелочных металлов является их реакция с водой. При контакте с водой щелочные металлы образуют гидроксиды и выделяются водород. Эта реакция характерна для всех щелочных металлов.
Реакция щелочных металлов с кислородом тоже вызывает большой интерес. Щелочные металлы формируют оксиды при нагреве в кислородной атмосфере. Например, натрий при нагреве в кислороде образует оксид натрия (Na2O). Это вещество обладает щелочными свойствами и растворяется в воде, образуя щелочную среду.
Реакции щелочных металлов с водой и кислородом демонстрируют высокую активность этих элементов и показывают, какие интересные соединения они образуют. Изучение этих реакций играет важную роль в современной химии и имеет множество практических применений в различных областях промышленности и науки.
Биологическое и медицинское значение щелочных металлов
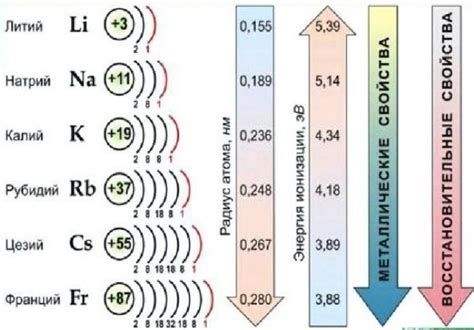
Щелочные металлы, такие как литий, натрий, калий и рубидий, играют важную роль в биологических и медицинских процессах. Они отвечают за множество функций в организме, включая регуляцию осмотического давления, передачу нервных импульсов и поддержание рН баланса.
Один из наиболее известных примеров использования щелочных металлов в медицине - это лечение биполярного расстройства. Литий, щелочный металл, применяется в качестве стабилизатора настроения, чтобы контролировать эпизоды депрессии и мании у пациентов с этим расстройством. Он также используется для лечения некоторых форм депрессии и болезни Альцгеймера.
Калий является еще одним важным щелочным металлом, который играет основную роль в функционировании клеток и мышц. Он необходим для контроля сердечного ритма и уровня кровяного давления. Недостаток калия может привести к серьезным нарушениям в работе сердца и мышц.
Натрий также играет важную роль в биологических процессах. Он контролирует уровень воды в организме и помогает поддерживать нормальное кровяное давление. Кроме того, натрий является необходимым компонентом внеклеточной жидкости, который помогает передавать нервные импульсы и поддерживать химическую реакцию в организме.
Щелочные металлы также используются в различных медицинских процедурах. Например, рубидий используется в некоторых методах ядерной медицины для диагностики и лечения определенных заболеваний. Кроме того, щелочные металлы часто используются в виде солей в качестве пищевых добавок и лекарственных препаратов для компенсации их недостатка в организме.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это элементы группы 1 периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. Они обладают сильной щелочной реакцией, то есть быстро реагируют с водой и выделяют водород. Также они хорошо растворимы в неполярных органических растворителях, образуя ионные соединения.
Какие свойства имеют щелочные металлы?
У щелочных металлов есть ряд характерных свойств. Они имеют низкую плотность и низкую температуру плавления, что делает их легкими и мягкими металлами. Они очень реактивны и легко окисляются воздухом, поэтому хранятся в масле или инертной среде. Щелочные металлы имеют низкую электроотрицательность, что делает их отличными веществами для создания щелочных растворов.
Какие применения имеют щелочные металлы?
Щелочные металлы имеют множество применений в различных областях. Например, литий используется для производства легких и прочных батарей, калий применяется в сельском хозяйстве для улучшения плодородия почвы, а натрий используется в производстве стекла и мыла. Некоторые щелочные металлы также используются в ядерной энергетике и в процессе обогащения руд.
