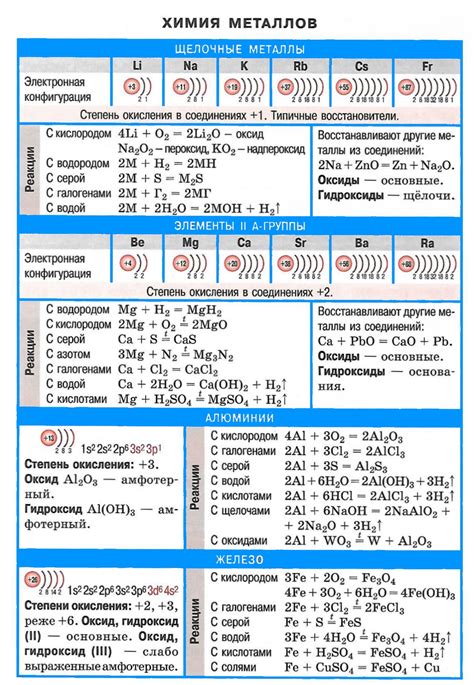
Щелочные металлы - это группа элементов периодической таблицы, которые относятся к первой группе. В эту группу входят литий, натрий, калий, рубидий, цезий и франций. Они получили свое название из-за своих основных химических свойств - они являются сильными основаниями и образуют щелочные растворы.
Литий - элемент с атомным номером 3. Он имеет наименьшую плотность и наименьшую температуру плавления среди всех щелочных металлов. Литий часто используется в аккумуляторах, взрывных устройствах и в легких сплавах.
Натрий - элемент с атомным номером 11. Он имеет низкую плотность и низкую температуру плавления. Натрий широко используется в производстве щелочей, стекла и мыла. Он также играет важную роль в поддержании баланса воды и электролитов в организме человека.
Калий - элемент с атомным номером 19. Калий является существенным макроэлементов для растений. Он играет важную роль в регуляции клеточного потенциала и баланса воды в растениях. Калий также необходим для нормального функционирования нервной системы и мышц у животных и человека.
Рубидий - элемент с атомным номером 37. Рубидий обладает схожими свойствами с калием и используется в некоторых научных исследованиях и в промышленности. Он также может использоваться в лечении биполярного расстройства.
Цезий - элемент с атомным номером 55. Цезий обладает самой низкой плотностью и самой низкой точкой плавления среди щелочных металлов. Он используется в исследованиях ядерной физики и в отраслях промышленности, таких как электроника и спутниковая связь.
Франций - элемент с атомным номером 87. Франций является самым редким и самым радиоактивным элементом среди щелочных металлов. Из-за своей высокой радиоактивности он имеет ограниченное применение в научных исследованиях.
Список всех щелочных металлов
Щелочные металлы, также называемые группой I элементов, включают в себя несколько химических элементов. Все они относятся к alcali metals в периодической таблице элементов. Вот список всех щелочных металлов:
- Литий (Li) - первый элемент группы I, который имеет атомный номер 3.
- Натрий (Na) - второй элемент группы I, имеет атомный номер 11.
- Калий (K) - третий элемент группы I, имеет атомный номер 19.
- Рубидий (Rb) - четвертый элемент группы I, имеет атомный номер 37.
- Цезий(Cs) - пятый элемент группы I, имеет атомный номер 55.
- Франций (Fr) - последний элемент группы I, имеет атомный номер 87.
Эти элементы обладают рядом общих химических свойств. Все щелочные металлы являются сильными щелочами и реагируют с водой, образуя щелочные растворы. Они также обладают низкими температурами плавления и кипения. Кроме того, щелочные металлы обладают высокой электропроводностью и невысокой твердостью.
Благодаря своим химическим свойствам и доступности, щелочные металлы находят широкое применение в различных областях, включая производство аккумуляторов, взрывчатых веществ, легирующих элементов и т.д. Эти элементы также играют важную роль в биологии, так как являются неотъемлемой частью органических соединений.
Описание и свойства

Щелочные металлы - группа металлов, относящихся к первой группе элементов периодической системы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все эти металлы реагируют с водой, образуя щелочные гидроксиды и выделяя водород.
Литий является самым легким щелочным металлом. Он имеет низкую плотность и высокую способность к реакциям с другими веществами. Натрий - распространенный элемент в природе, имеет серебристо-белый цвет и является необходимым элементом для жизни организмов. Калий используется в удобрениях и является важным элементом для нормального функционирования организма человека.
Щелочные металлы обладают высокой реактивностью и легко окисляются. Они образуют оксиды, нитриды и гидриды. Кроме того, щелочные металлы являются характерными элементами для пламени, придающим ему ярко-желтый цвет.
Сильная щелочность гидроксидов щелочных металлов очень опасна для органических тканей, поэтому при работе с ними необходима осторожность. Кроме того, щелочные металлы могут вызывать горение при контакте с кислородом или другими воспламеняющимися веществами.
Вопрос-ответ

Какие металлы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие химические свойства отличают щелочные металлы?
Основные химические свойства щелочных металлов включают высокую реактивность, способность образовывать ионы с положительным зарядом (катионы), обладать низкой температурой плавления и кипения, а также образовывать сильные основания. Они также обладают низкой плотностью, мягкостью и низкой твердостью.
Какова роль щелочных металлов в природе и в промышленности?
Щелочные металлы имеют широкое применение в природе и промышленности. Они играют важную роль в металлургии, электрохимии и производстве стекла. Например, натрий используется в производстве щелочей, стекла, мыла и бумаги. Калий применяется в удобрениях и в качестве химического реагента. Литий используется в производстве аккумуляторов и лекарственных препаратов.
Какие опасности могут быть связаны с щелочными металлами?
Щелочные металлы могут быть опасными при неправильном обращении с ними. Они очень реактивны и могут взрываться или гореть при контакте с водой или воздухом. Кроме того, некоторые щелочные металлы, такие как литий и натрий, являются токсичными и могут вызывать вредные последствия при попадании на кожу или в организм. Поэтому необходимо соблюдать особые меры предосторожности при работе с этими веществами.
