Щелочные металлы – это элементы, которые формируют первую группу периодической системы химических элементов. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются самыми активными химическими элементами, обладающими низкой электроотрицательностью и высокой реакционной способностью.
Получение щелочных металлов осуществляется путем электролиза их солей или реакции гидрида щелочного металла с водой. Например, литий можно получить путем электролиза расплава его хлорида, а натрий – реакцией гидрида натрия с водой. Однако, из-за их высокой реакционной способности, щелочные металлы встречаются в природе только в виде соединений, таких как карбонаты или сульфаты и даже могут взрываться в контакте с влажным воздухом.
Химические свойства щелочных металлов определяют их возможности и применение в различных областях. Они обладают высокой электропроводностью, плохо растворимы в органических растворителях и образуют единственную положительную ионную форму, что делает их важными элементами для производства батарей и аккумуляторов. Кроме того, они обладают способностью образовывать соединения с водой, что делает их важными в области химической аналитики и лабораторной практике.
Применение щелочных металлов включает создание легких и прочных материалов, производство удобрений, стекла, моющих средств, а также использование в фармацевтической и электронной промышленности. Кроме того, некоторые из них, такие как литий-ионные аккумуляторы, имеют большую емкость и долговечность, что делает их незаменимыми компонентами для различных электротехнических устройств.
Определение и особенности щелочных металлов

Щелочные металлы - это элементы, которые относятся к первой группе периодической таблицы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются особыми свойствами, которые отличают их от других элементов.
Первая особенность этих металлов заключается в их низкой плотности. Например, литий имеет наименьшую плотность среди металлов. Это связано с их малым атомным радиусом и низкой атомной массой. Благодаря этой характеристике, щелочные металлы обладают большой плавучестью и могут плавать на поверхности воды.
Вторая особенность связана с их реакцией с водой. Щелочные металлы очень реактивны и быстро реагируют с водой, выделяя водород и образуя гидроксид металла. Эта реакция сопровождается выделением большого количества тепла, что может привести к возгоранию газообразного водорода.
Третья особенность щелочных металлов - их высокая химическая реактивность. Они легко реагируют с кислородом, образуя оксиды металла. Также, они могут реагировать с другими элементами и соединениями, образуя различные соли.
Щелочные металлы имеют широкое применение в различных сферах. Например, калий используется в сельском хозяйстве для удобрения почвы. Натрий широко применяется в пищевой промышленности и в производстве стекла. Рубидий используется в ядерной энергетике и в оптике. Использование щелочных металлов в различных областях признано благодаря их уникальным свойствам и характеристикам.
Способы получения щелочных металлов

1. Электролиз растворов щелочных солей. Данный метод основан на применении электрического тока для разложения щелочных солей на их составные элементы – металлы. В этом процессе применяются специальные электролитические ячейки и электроды, которые позволяют проводить электролиз с высокой эффективностью.
2. Реакции металлов с водой. Некоторые щелочные металлы, например, натрий и калий, реагируют с водой, образуя гидроксиды и выделяя при этом водород. В этом случае получение металлов происходит в ходе диспропорционирования – один атом металла окисляется, а другой атом восстанавливается.
3. Использование реакций с негалогенными галогенидами. Щелочные металлы можно получить путем реакции соответствующих галогенидов (например, хлорида) с негалогенными веществами, такими как металлы алюминий, железо или кальций. В результате такой реакции галогенид металла превращается в металл и образуется галоген.
4. Термическое восстановление оксида щелочного металла. Этот метод основан на нагревании оксида щелочного металла с применением специальных восстановителей, таких как уголь или диоксид серы. В результате такой реакции оксид восстанавливается до металлического состояния.
5. Пиролиз органических соединений щелочных металлов. Одним из способов получения щелочных металлов является термическое разложение органических соединений, содержащих эти металлы. Например, мочевину можно разложить при нагревании, получив при этом карбонаты щелочных металлов.
6. Переработка отходов. Щелочные металлы могут быть получены из переработки различных отходов, таких как старые аккумуляторы или отработанное масло, содержащее щелочные компоненты. Для этого применяют различные химические и физические методы экстракции и очистки.
Таким образом, существуют различные способы получения щелочных металлов, каждый из которых имеет свои преимущества и области применения. Выбор метода зависит от конкретных условий и требований производства.
Химические свойства щелочных металлов

Щелочные металлы являются самыми активными химическими элементами в периодической системе и имеют ряд уникальных химических свойств.
Во-первых, щелочные металлы хорошо реагируют с водой, образуя щелочные растворы. При взаимодействии с водой происходит выделение водорода и образование щелочи. Например, натрий (Na) реагирует с водой, образуя щелочной раствор натрия и выделяя водород:
2Na + 2H2O -> 2NaOH + H2
Во-вторых, щелочные металлы обладают высокой активностью в реакциях с кислородом. Они легко окисляются до ионов металла и выделяют большое количество тепла. Например, литий (Li) реагирует с кислородом, образуя оксид лития и выделяя тепло:
4Li + O2 -> 2Li2O + тепло
В-третьих, щелочные металлы образуют стабильные катионы, которые легко образуют соли. Это связано с тем, что у них всего один электрон на внешнем энергетическом уровне, который легко отдается. Например, калий (K) образует катион K+, который образует множество разных солей, таких как хлорид калия (KCl) или сульфат калия (K2SO4).
В-четвертых, щелочные металлы реагируют с многими другими веществами и образуют различные соединения. Например, они реагируют с кислотами, образуя соли, с неметаллами, образуя простые вещества, и с другими металлами, образуя сплавы.
Таким образом, химические свойства щелочных металлов обусловлены их высокой активностью, способностью образовывать щелочные растворы, реактивностью с кислородом и способностью образовывать стабильные катионы и различные соединения.
Взаимодействие щелочных металлов с водой и кислотами

Щелочные металлы - это элементы первой группы периодической системы, к которым относятся литий, натрий, калий, рубидий, цезий и франций. Они проявляют активность в химических реакциях, особенно при взаимодействии с водой и кислотами.
Когда щелочные металлы взаимодействуют с водой, происходит реакция, в результате которой образуется щелочь (гидроксид металла) и выделяется водород. Например, литий реагирует с водой, образуя гидроксид лития и водород. При этом реакция сильно экзотермическая, то есть сопровождается выделением тепла.
Щелочные металлы также реагируют с кислотами, образуя соль и выделяя водород. Например, натрий реагирует с соляной кислотой, образуя хлорид натрия и водород. Взаимодействие щелочных металлов с кислотами также является сильно экзотермическим процессом.
Взаимодействие щелочных металлов с водой и кислотами является одним из основных методов получения гидроксидов металлов и солей. Эти соединения широко используются в различных отраслях промышленности, а также в лабораторных условиях для проведения химических экспериментов и синтеза различных веществ.
Щелочные металлы в природе и в живых организмах
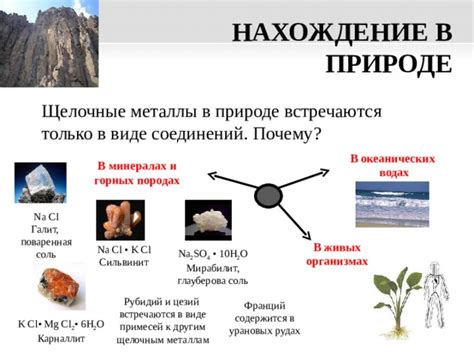
Щелочные металлы являются одними из самых распространенных элементов в земной коре. Они представлены главным образом литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs). Эти металлы имеют глубокое влияние на различные процессы в природе и играют важную роль в живых организмах.
В природе щелочные металлы часто встречаются в виде минералов, например, силикатов. Они могут быть обнаружены в почве, горных породах, воде и воздухе. Кроме того, эти металлы могут существовать в виде ионов в морской воде и других водных растворах.
Щелочные металлы играют важную роль в живых организмах, особенно в растениях. Например, калий (K) необходим для нормального роста и развития растений, регулирует открытие и закрытие клеточных каналов и участвует в поддержании осмотического давления. Натрий (Na) также является важным ионом для растений, особенно для поддержания водного баланса.
Однако, участие щелочных металлов в живых организмах не ограничивается только растениями. Они также играют роль в животных и человеке. Например, натрий (Na) и калий (K) являются важными ионами для нервной системы и участвуют в передаче нервных импульсов. Литий (Li) также используется в медицине для лечения психических заболеваний, таких как биполярное расстройство.
В целом, щелочные металлы имеют значительное влияние на природу и живые организмы. Их наличие в земной коре и воздухе, а также их ионные формы в растениях и животных, позволяют им выполнять важные функции и обеспечивать нормальное функционирование различных систем организмов.
Применение щелочных металлов в промышленности и быту

Щелочные металлы, такие как литий, натрий и калий, широко применяются в промышленности и быту благодаря своим уникальным химическим свойствам.
Натрий является одним из основных компонентов пищевых добавок, таких как поваренная соль и сода. Он также используется при производстве стекла, мыла, моющих средств и металлов. Кроме того, натрий является необходимым компонентом в процессе электролиза и аккумуляторах.
Калий применяется в сельском хозяйстве, где он является неотъемлемым элементом удобрений и для поддержания pH в почве. Он также используется в производстве стекла, мыла и моющих средств. Калий является важным компонентом при производстве огнетушителей, водорозжигателей и косметических средств.
Литий имеет широкое применение в производстве аккумуляторов, особенно в литий-ионных батареях, которые используются в мобильных устройствах и электромобилях. Он также используется в производстве стекла, литий-алюминиевых сплавов и лекарств. Кроме того, литий имеет специальное применение в ядерной энергетике и в космической промышленности.
В целом, применение щелочных металлов в промышленности и быту играет важную роль в создании различных продуктов и технологий, которые мы используем в повседневной жизни.
Опасность и меры безопасности при работе с щелочными металлами

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, могут представлять опасность при работе с ними из-за своих химических свойств. Они являются весьма активными элементами, способными реагировать с водой и органическими веществами. В результате таких реакций могут выделиться взрывоопасные газы, такие как водород или аммиак.
При работе с щелочными металлами необходимо соблюдать ряд мер безопасности. В первую очередь, важно надлежащим образом хранить эти материалы. Щелочные металлы должны храниться под слоем не реагирующих с ними веществ, таких как минеральное масло или керосин, чтобы предотвратить контакт с воздухом и влагой.
При работе с щелочными металлами необходимо использовать защитные средства, такие как защитные очки, халат, химически устойчивые перчатки и респиратор, чтобы предотвратить контакт с кожей, глазами и дыхательными путями. Также рекомендуется работать в хорошо проветриваемом помещении или под вытяжкой для удаления выделяющихся газов.
В случае несчастного случая с щелочными металлами необходимо сразу принять меры к ликвидации опасности. При попадании щелочного металла на кожу или в глаза, необходимо немедленно промыть большое количество холодной воды и обратиться к врачу. В случае разлива щелочного металла следует накрывать его минеральным маслом или керосином, чтобы предотвратить контакт с воздухом и водой, и немедленно вызывать специализированные службы для его удаления.
Таким образом, работа с щелочными металлами требует соблюдения строгих мер безопасности, чтобы предотвратить риски и обеспечить безопасные условия работы.
Вопрос-ответ

Какие металлы относятся к щелочным?
К щелочным металлам относятся такие элементы как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Каким образом получают щелочные металлы?
Щелочные металлы получают путем электролиза или разложения их соединений, таких как гидроксиды или хлориды. Некоторые щелочные металлы также могут быть получены из природных руд.
Какие химические свойства характерны для щелочных металлов?
У щелочных металлов есть несколько общих химических свойств. Они очень реактивны и легко реагируют с водой, воздухом и другими веществами. Они образуют гидроксиды при реакции с водой и образуют соли при взаимодействии с кислотами. Они имеют низкий плотность, низкую температуру плавления и высокую электропроводность.
