Щелочные металлы - это группа элементов, находящихся в первой группе (группа 1) периодической системы химических элементов. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы имеют множество уникальных химических и физических свойств, которые делают их важными для различных областей науки и технологий.
Один из главных характеристических признаков щелочных металлов - это их высокая реактивность. Это связано с тем, что они имеют один валентный электрон во внешней оболочке, что делает их очень неустойчивыми и склонными к реакциям с другими химическими элементами. Эта реактивность может проявляться в различных формах, включая воспламенение, растворение в воде и реакции с кислородом.
Одной из наиболее известных особенностей щелочных металлов является их способность образовывать характерные оксиды, которые образуют плотные пленки на поверхности металла и защищают его от дальнейшей реакции с окружающей средой. Благодаря этому свойству щелочные металлы могут использоваться в различных процессах и технологиях, включая производство батарей, легирование и производство оптических стекол.
Щелочные металлы: что это и чем они интересны

Щелочные металлы - это группа химических элементов, включающая литий(Li), натрий(Na), калий(K), рубидий(Rb), цезий(Cs) и франций(Fr). Они находятся в первой группе периодической системы и имеют одну электронную оболочку, что делает их наиболее активными металлами.
Прежде всего, щелочные металлы обладают высокой реактивностью. Они легко взаимодействуют с кислородом, водой и большинством других элементов, образуя сильно щелочные растворы. Это делает их незаменимыми в химической промышленности для производства технических щелочей.
Особенностью щелочных металлов является их огнестойкость. Они способны гореть в воздухе с яркой пламенем, что делает их важными компонентами для производства пиротехнических смесей.
Щелочные металлы также славятся своей способностью к образованию сплавов с другими металлами. Это открывает широкие возможности для использования их в производстве различных сплавов с железом, алюминием и другими металлами, что позволяет создавать материалы с улучшенными характеристиками.
Также следует отметить, что щелочные металлы играют важную роль в биологии. Они являются важными элементами в организмах живых существ и выполняют различные функции, такие как поддержка работы нервной системы, регулирование водного баланса и участие в белковом обмене.
В заключение, щелочные металлы - это уникальная группа элементов, обладающих высокой реактивностью, огнестойкостью и способностью к образованию сплавов. Они являются неотъемлемой частью нашей жизни и находят широкое применение в различных областях, от промышленности до биологии.
Определение и классификация щелочных металлов
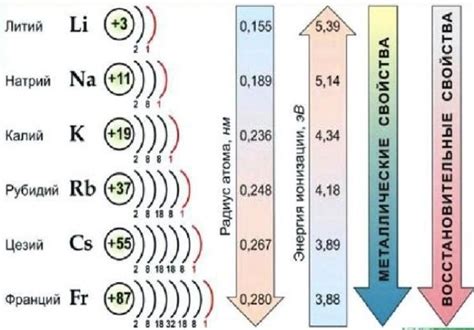
Щелочные металлы – это группа элементов, которые относятся к первой группе периодической системы химических элементов. Они также известны как первая группа, или группа щелочных металлов. Главной особенностью щелочных металлов является их сильное щелочное действие, обусловленное высокой реактивностью на воздухе и воде. В свободном состоянии щелочные металлы представлены мягкими металлическими элементами, обладающими низкой плотностью и низкой температурой плавления.
Щелочные металлы классифицируются на основе атомной массы и химических свойств. Классификация включает следующие элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все эти элементы имеют одинаковую химическую структуру и общую электронную конфигурацию, что делает их подобными между собой. Однако, каждый щелочный металл обладает своими характеристиками и особенностями.
- Литий (Li): является самым легким металлом, обладает низкой плотностью и высокой реактивностью. Используется в литий-ионных аккумуляторах, стекле и пиросожигателях.
- Натрий (Na): имеет ярко-желтый цвет и является более реактивным, чем литий. Используется в пищевой промышленности, производстве стекла и соединений натрия.
- Калий (K): обладает серебристо-белым цветом и сильной реакцией с водой. Широко используется в удобрениях и производстве синтетических соединений.
- Рубидий (Rb): имеет мягкий серебристый блеск и высокую реактивность. Применяется в научных исследованиях, электронике и производстве лазеров.
- Цезий (Cs): характеризуется мягкостью и низкой плотностью. Используется в исследованиях атомной физики и в некоторых медицинских приборах.
- Франций (Fr): самый редкий и радиоактивный из шестерки щелочных металлов. Применяется только в научных исследованиях.
В целом, щелочные металлы являются важными элементами в науке, промышленности и повседневной жизни. Их химические и физические свойства делают их полезными в различных областях, начиная от производства стекла и удобрений, заканчивая применением в литий-ионных аккумуляторах и научных исследованиях. Понимание определения и классификации щелочных металлов помогает углубить знания о химических элементах и их ролях в нашем мире.
Физические и химические свойства щелочных металлов
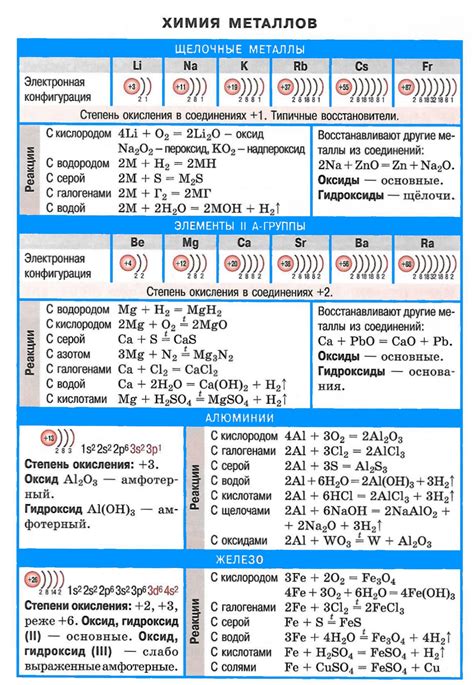
Щелочные металлы представлены элементами первой группы периодической системы, а именно: литием, натрием, калием, рубидием, цезием и францием. Эти металлы обладают рядом уникальных физических и химических свойств, которые определяют их поведение и важность в науке и технологиях.
Физические свойства щелочных металлов включают низкую плотность, низкую температуру плавления и высокую теплопроводность. Благодаря низкой плотности, щелочные металлы способны плавать на поверхности воды, что делает их легкими и подвижными. Низкая температура плавления позволяет легко переводить эти металлы в жидкое состояние при небольших температурах.
Химические свойства щелочных металлов заключаются в их реактивности и способности образовывать ионы с положительным зарядом. Эти металлы легко окисляются при контакте с воздухом или водой, образуя оксидные пленки на своей поверхности. Они имеют высокую активность во многих химических реакциях, включая реакции с кислородом и восстановление других веществ.
Другой важной химической особенностью щелочных металлов является их способность образовывать сильные щелочные растворы с водой. Натрий, калий и другие металлы первой группы реагируют с водой, выделяя водородный газ и образуя щелочные растворы, такие как гидроксид натрия или гидроксид калия. Эта реакция является химической основой многих обычных химических процессов, таких как мыло- и стеклопроизводство.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий, калий и рубидий, имеют широкое применение в промышленности благодаря своим уникальным химическим свойствам.
Одним из главных применений щелочных металлов является производство щелочей. Натрий и калий активно применяются в процессе производства щелочей, которые используются в производстве стекла, мыла, бытовых моющих средств и других химических продуктов.
Кроме того, щелочные металлы применяются в производстве батареек и аккумуляторов. Литий-ионные аккумуляторы, которые являются наиболее распространенными типами аккумуляторов в современных устройствах, используют литий в качестве активного материала.
В промышленности есть и другие применения щелочных металлов. Например, натрий применяется в производстве алюминия, калий используется в производстве удобрений, а рубидий применяется в электронике для создания отдельных компонентов и устройств.
Также стоит отметить, что некоторые щелочные металлы имеют широкое применение в ядерной энергетике. Например, литий используется в производстве термоядерных реакторов и служит для создания условий, необходимых для осуществления контролируемых ядерных реакций.
- Щелочные металлы широко применяются в промышленности.
- Они используются для производства щелочей, батареек, аккумуляторов и других химических продуктов.
- Натрий используется в производстве алюминия, калий - в производстве удобрений, рубидий - в электронике.
- Литий применяется в ядерной энергетике для создания условий для контролируемых ядерных реакций.
Влияние щелочных металлов на окружающую среду и здоровье человека

Щелочные металлы (литий, натрий, калий, рубидий, цезий и франций) имеют существенное влияние на окружающую среду и здоровье человека.
Окружающая среда часто подвергается загрязнению от выбрасывания и использования щелочных металлов в промышленности и энергетике. Например, натрий и калий являются частыми компонентами в промышленных отходах и нефтяных разливах. Когда эти металлы попадают в воду или почву, они могут вызвать серьезные проблемы экосистемы, включая загрязнение питьевой воды и токсичность для растений и животных.
Здоровье человека также может быть неблагоприятно затронуто воздействием щелочных металлов. Например, высокий уровень натрия в пище может привести к повышенному давлению и сердечным заболеваниям. Литий используется в медицине для лечения психических расстройств, но при его неконтролируемом потреблении могут возникнуть побочные эффекты, такие как тревога, расстройства сна и нервная система. Цезий-137, радиоактивный изотоп цезия, который образуется в результате ядерных взрывов или аварий на ядерных электростанциях, имеет долгосрочное радиоактивное влияние на организм человека, вызывая рак и нарушение работы щитовидной железы.
Таким образом, необходимо учитывать влияние щелочных металлов на окружающую среду и своё здоровье. Регулирование выбросов и использование альтернативных материалов и технологий помогут минимизировать негативные последствия и сохранить экологическую устойчивость и здоровье человека.
Интересные факты о щелочных металлах

1. Самая легкая металлическая группа
Щелочные металлы представляют собой самую легкую группу металлов в периодической системе химических элементов. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Благодаря своей низкой плотности и малому атомному радиусу они обладают особыми свойствами и широко используются в различных областях науки и технологий.
2.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это элементы группы 1 таблицы химических элементов, они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие особенности есть у щелочных металлов?
Основные особенности щелочных металлов - это их высокая реакционная способность с водой, образование оксида при взаимодействии с кислородом и образование солей при реакции с кислотами.
Какие есть применения для щелочных металлов?
Щелочные металлы имеют множество применений в различных отраслях. Например, натрий используется для производства пищевых добавок, литий применяется в легких аккумуляторах, а калий является необходимым элементом для растений.
Каким образом щелочные металлы взаимодействуют с водой?
Щелочные металлы реагируют с водой с образованием щелочей и водорода. При этой реакции освобождается большое количество тепла и металлы полностью растворяются в воде.
Какие опасности могут возникать при работе с щелочными металлами?
Работа с щелочными металлами может быть опасна из-за их высокой реакционной способности. Они могут вызывать ожоги на коже и слизистых оболочках. Кроме того, взаимодействие щелочных металлов с водой может привести к образованию взрывоопасного водорода.
