Щелочные металлы являются элементами периодической системы, которые принадлежат к первой группе. Всего в этой группе находятся шесть элементов: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются своими физическими и химическими свойствами от других элементов.
Ключевым характерным свойством щелочных металлов является их высокая реактивность. Они очень активно реагируют с водой, кислородом и другими реагентами. Это связано с их низкой ионизационной энергией, что позволяет легко отделять электроны и образовывать ионы положительного заряда.
Одной из наиболее характерных черт щелочных металлов является их мягкость и низкая температура плавления. Они обладают специфическим блеском и на вид напоминают пластичные металлы. Также щелочные металлы обладают высокой проводимостью тепла и электричества.
Важно отметить, что щелочные металлы имеют важное применение в различных отраслях научных и технических дисциплин. Калий и натрий используются в производстве удобрений, литий применяется в батареях и промышленности стекла, а рубидий в сверхпроводимости и атомных часах.
В заключение, щелочные металлы представляют собой важный класс элементов периодической таблицы, который характеризуется своей высокой реактивностью, мягкостью и специфическими химическими свойствами. Они находят широкое применение в различных технических и научных областях, благодаря своим уникальным характеристикам.
Щелочные металлы и их место в периодической таблице
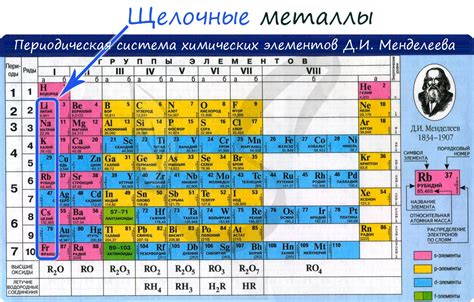
Щелочные металлы представляют собой группу 1 элементов периодической таблицы. В состав этой группы входят такие химические элементы, как литий, натрий, калий, рубидий, цезий и франций. Они отличаются высокой реактивностью и активностью в химических реакциях.
Эти элементы обладают общими характеристиками, такими как низкая плотность, низкая температура плавления и небольшая твердость. Щелочные металлы имеют один электрон во внешней энергетической оболочке и легко отдают его, образуя положительный ион. Это делает их очень реактивными и способными вступать в химические соединения с другими элементами.
Щелочные металлы занимают первую группу периодической таблицы, что отражает их сходство в химических свойствах. Они располагаются в левой части таблицы и образуют период, состоящий из одной электронной оболочки. На периодической таблице они обозначаются сокращением IA.
Эти элементы имеют широкое применение в разных сферах нашей жизни. Натрий используется в пищевой промышленности для приготовления пищевых добавок, калий является важным элементом для растений и используется в сельском хозяйстве, а литий применяется в производстве аккумуляторов и лекарств. Их реактивность и активность делают их полезными в различных химических реакциях и процессах.
Девять важнейших элементов химических элементов
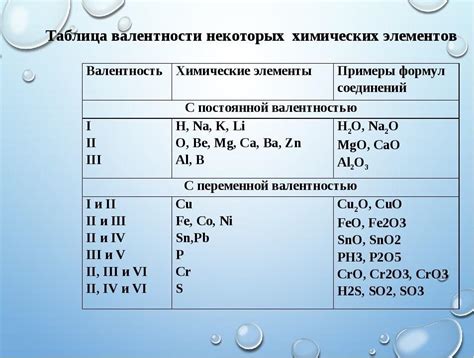
1. Водород – самый легкий химический элемент, обладает высокой химической активностью и может реагировать со многими другими элементами. Широко используется в производстве водородных батарей и в процессе химического синтеза различных соединений.
2. Гелий – второй по легкости элемент, неподвижен, безвреден для человека. Используется в аэростатике, при создании контролируемой атмосферы, в анализе газов и медицине.
3. Литий – мягкий, серебристо-белый металл, встречается в природе в виде солей. Используется в производстве аккумуляторов, ядерных реакторах, лекарственных препаратах.
4. Натрий – металл серебристо-белого цвета, реагирует с водой с пламенем. Используется в производстве щелочей, пищевой промышленности и при производстве стекла.
5. Калий – металл с серебристо-белым цветом, реагирует с водой, легко окисляется. Важный элемент для растений, а также применяется в производстве удобрений и пиротехнических смесей.
6. Рубидий – мягкий серебристо-белый металл, сходен по своим свойствам с калием и натрием. Применяется в научных исследованиях, в приборостроении и в производстве стекла и электролитических смесей.
7. Цезий – очень мягкий серебристо-белый металл, самый реактивный из щелочных металлов. Используется в научных исследованиях, в часах и в высокоточных приборах.
8. Франций – самый редкий и самый тяжелый из щелочных металлов, обладает очень высокой радиоактивностью. Из-за своей высокой стоимости и опасности франций имеет незначительное практическое применение.
9. Унунпентий – синтетический элемент, относится к группе щелочных металлов. Его открытие подтверждено, однако практическое применение пока отсутствует.
Первая группа периодической таблицы химических элементов
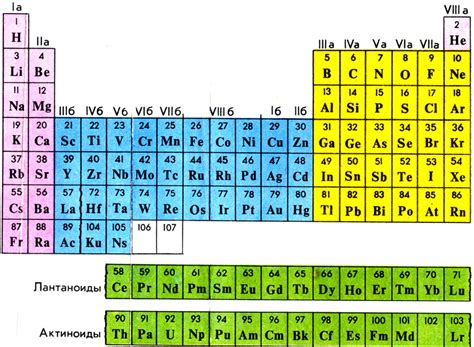
Первая группа периодической таблицы химических элементов состоит из щелочных металлов. В данную группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы характеризуются малой плотностью, низкой температурой плавления и кипения, высокой химической активностью и относительно мягкой структурой.
Щелочные металлы обладают высокой реактивностью и легко реагируют с водой, кислородом и другими веществами. Они образуют гидроксиды, оксиды и соли, которые обладают высокой растворимостью в воде. Большинство щелочных металлов имеют серебристо-белый цвет и мягкую текстуру, что позволяет их резать ножом или ручным инструментом. Они также являются хорошими проводниками электричества и тепла.
Важным с точки зрения научных и практических исследований являются физические и химические свойства щелочных металлов. Например, благодаря сочетанию низкой плотности и высокой реактивности литий широко применяется в производстве легких аккумуляторов. Натрий используется в химической промышленности для производства строительных материалов и пищевых добавок. Калий является необходимым элементом для растительной жизни и используется в сельском хозяйстве.
- Литий
- Натрий
- Калий
- Рубидий
- Цезий
- Франций
Хотя щелочные металлы имеют много полезных свойств, они также хорошо известны своей высокой реактивностью и инертностью в воздухе. Поэтому многие из них хранятся в масляном или восковом покрытии, чтобы предотвратить их окисление. Благодаря своим уникальным свойствам, щелочные металлы находят широкое применение в различных областях, включая химическую промышленность, электронику, фармакологию и энергетику.
Вопрос-ответ

Какие элементы относятся к щелочным металлам?
Щелочные металлы включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Что характерно для щелочных металлов?
Щелочные металлы обладают химическими свойствами, характерными для своей группы: они очень реактивны, легко образуют ионы с положительным зарядом, способны взаимодействовать с водой, образуя щелочные растворы.
Какие свойства щелочных металлов делают их ценными в нашей повседневной жизни?
Щелочные металлы широко используются в различных сферах: от производства щелочей и моющих средств до производства аккумуляторов и лекарств. Они также играют важную роль в металлургии и ядерной энергетике.
Какие опасности связаны с использованием щелочных металлов?
Щелочные металлы очень реактивны и могут быть опасными при неправильном обращении с ними. Они могут прореагировать с водой или кислородом в воздухе, что может привести к возгоранию или взрыву. Кроме того, они могут быть токсичными при контакте с кожей или вдыхании паров.
Каким образом щелочные металлы находят применение в лекарстве?
Некоторые соединения щелочных металлов, особенно литий, имеют фармакологические свойства и используются в медицине. Например, литий применяется в лекарственных препаратах для лечения биполярного аффективного расстройства и депрессии.
