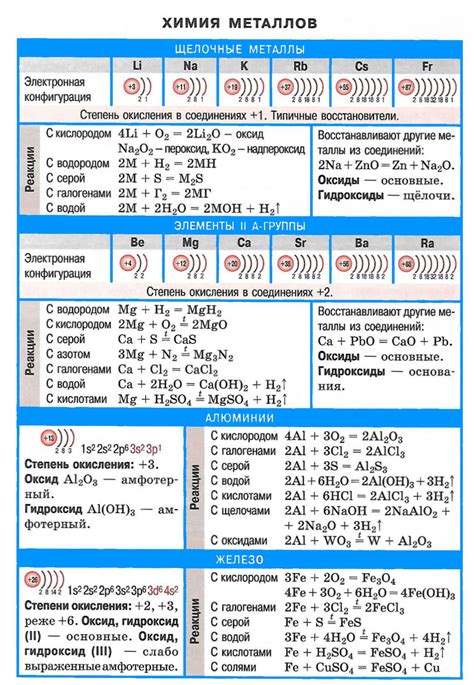
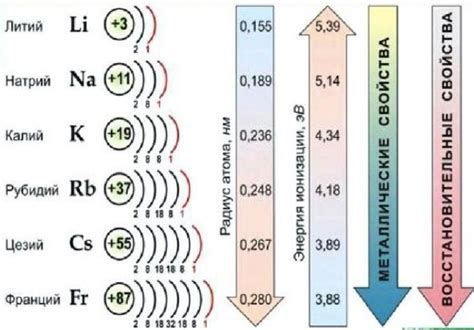
Щелочные металлы представляют собой группу элементов, которые относятся к первой группе периодической системы химических элементов. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все эти элементы обладают рядом общих химических и физических свойств.
Основными особенностями щелочных металлов являются их низкая плотность, низкая температура плавления и кипения, а также высокая активность. Они обладают мягкой консистенцией и могут быть легко раскатаны в виде листа или проволоки. Кроме того, вещества, содержащие щелочные металлы, обладают яркими цветами, что делает их использование в области химии и электроники особенно важным.
У каждого из щелочных металлов есть свои характерные свойства. Например, литий является самым легким металлом, имеет низкую плотность и высокую химическую активность. Натрий обладает относительно низкой плотностью и распространенностью в природе, а также является ключевым компонентом пищевых добавок и применяется в производстве стекла и мыла. Калий широко используется в сельском хозяйстве и является необходимым элементом питания для растений и животных. Рубидий, цезий и франций применяются в различных научных и исследовательских работах.
Щелочные металлы: основные свойства и химические реакции
Щелочные металлы — это группа элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они характеризуются реакционной способностью и обладают рядом особых свойств.
Основное свойство щелочных металлов — реакция с водой. Каждый из них может реагировать с молекулами воды, образуя щелочь и выделение водорода. Реакция лития с водой является самой интенсивной, а франций, самый редкий элемент, реагирует очень активно и взрывоопасно.
Щелочные металлы имеют низкую плотность, мягкие и низкотемпературные металлы. Они легко режутся ножом и имеют низкую температуру плавления. На воздухе они быстро окисляются, образуя оксидные пленки.
Щелочные металлы имеют высокую электропроводность, их ионы легко двигаются в растворах. За счет этого они широко применяются в различных электрохимических процессах, а также в изготовлении щелочных элементов, используемых, например, в батареях.
Щелочные металлы еще и являются катализаторами некоторых реакций, таких как реакция Габриелы-Фальгасова, которая применяется в органическом синтезе.
Обратим внимание на таблицу с основными свойствами щелочных металлов:
| Элемент | Плотность | Температура плавления | Реакция с водой |
|---|---|---|---|
| Литий | 0,53 г/см³ | 180,5 °C | Реагирует с выделением водорода |
| Натрий | 0,97 г/см³ | 97,8 °C | Реагирует с выделением водорода |
| Калий | 0,86 г/см³ | 63,7 °C | Реагирует с выделением водорода |
| Рубидий | 1,53 г/см³ | 38,9 °C | Реагирует с выделением водорода |
| Цезий | 1,93 г/см³ | 28,5 °C | Реагирует с выделением водорода |
| Франций | низкая плотность | низкая температура плавления | Реагирует с выделением водорода |
Литий: малый загадочный металл

Литий – химический элемент с атомным номером 3 и обозначением Li. Этот элемент является одним из самых легких твердых металлов и является членом щелочных металлов 1-й группы периодической системы.
Литий получил свое название от греческого слова "lithos", что означает "камень", в связи с его каменной текстурой и жесткостью. Основными носителями лития являются различные минералы, такие как сподумен, лепидолит и пегматиты.
Литий обладает рядом особенных свойств. Во-первых, он является самым легким металлом ит светлым блеском. Во-втроых, литий является самым реактивным металлом из всех щелочных металлов, способным реагировать с водой и даже гореть при контакте с воздухом. Это свойство делает его важным компонентом в производстве литий-ионных батарей, которые используются в современной электронике, такой как мобильные телефоны и ноутбуки.
Литий также имеет множество других применений. Он используется в производстве легких сплавов, которые применяются в авиационной и автомобильной промышленности, а также в производстве литий-медицинских препаратов для лечения биполярного расстройства. Кроме того, литий имеет свойства стабилизации настроений, что делает его полезным ингредиентом в некоторых антидепрессантах и препаратах для лечения психических расстройств.
Натрий: распространенный элемент в нашей жизни

Натрий – один из наиболее распространенных элементов в природе. Он является очень важным элементом для жизни и здоровья человека. Натрий содержится во многих продуктах питания, а также в природных источниках. Этот элемент имеет символ Na и атомный номер 11.
Одним из главных свойств натрия является его способность к реакциям с водой и кислородом. При контакте с водой, натрий образует гидроксид, который широко используется в различных областях. Натрий также способен реагировать с кислородом, образуя оксид, который используется в производстве стекла и щелочей.
Натрий также активно используется в пищевой промышленности. Он добавляется в различные продукты как пищевая добавка E500, чтобы улучшить их вкус и консистенцию. Натрий также широко применяется в производстве мороженого и шоколада, а также в качестве консерванта для мясных изделий.
Благодаря своим свойствам и распространенности в природе, натрий является неотъемлемой частью нашей жизни. Он играет важную роль в пищевой и химической промышленности, а также в нашем ежедневном питании. Правильное питание и употребление продуктов, содержащих натрий, поможет поддерживать здоровье организма и обеспечить его нормальное функционирование.
Калий: ключевой элемент для организма человека

Калий является одним из самых важных элементов, необходимых для нормального функционирования организма человека. Он относится к щелочным металлам и является макроэлементом, то есть его нужно получать с пищей в больших количествах.
Калий играет ключевую роль в регуляции водно-солевого обмена и уравновешивании осмотического давления в организме. Он участвует в передаче нервных импульсов, сокращении мышц, регулировании сердечного ритма и поддержании здоровой функции почек.
Недостаток калия в организме может вызвать различные негативные последствия:
- Мышечные слабости и судороги.
- Утомляемость и слабость.
- Аритмия и сердечное заболевание.
- Повышенный риск развития гипертонии и камней в почках.
- Нарушение работы нервной системы.
Для поддержания нормального уровня калия в организме рекомендуется употреблять пищу, богатую этим элементом. К таким продуктам относятся бананы, картофель, орехи, молочные продукты, рыба, зеленый горошек и многие другие. Кроме того, в качестве дополнительного источника калия можно принимать специальные препараты, назначенные врачом.
Рубидий: элемент с необычными физическими свойствами

Рубидий - щелочной металл, который обладает необычными физическими свойствами и является сравнительно редким элементом на Земле. Он был впервые обнаружен в 1861 году российским химиком и физиком Робертом Баннером и получил свое название от латинского слова "rubidus", что означает "темно-красный". Именно этот цвет рубидия стал его одной из самых узнаваемых особенностей.
Одним из самых примечательных свойств рубидия является его низкая плотность - всего 1,532 г/см³, что делает его одним из самых легких металлов. Рубидий обладает также очень низкой температурой плавления - всего 39,3 °C, что делает его одним из наиболее распространенных элементов в метеоритных образцах и вулканической лаве.
Важным свойством рубидия является его высокая химическая реактивность. Этот элемент быстро окисляется воздухом и взаимодействует с водой, образуя рубидиевую щелочь и высвобождая гидроген. Рубидий также реагирует с большинством неметаллов, образуя соединения с различными свойствами.
Рубидий широко применяется в научных исследованиях и в технологии. Его используют в производстве цветных стекол, в виде фоточувствительного материала в фотографии, а также в производстве ярких огней и фейерверков. Благодаря своей уникальной реактивности рубидий находит применение и в медицине - его используют для создания искусственного стимулятора сердца.
Цезий: самый реактивный и тяжелый щелочной металл

Цезий (Cs) – это химический элемент из группы щелочных металлов, который обладает рядом уникальных свойств. Он является самым реактивным металлом в своей группе и одним из самых реактивных элементов вообще. Цезий обладает высокой активностью, способностью реагировать с большинством неорганических и органических веществ.
Кроме того, цезий является самым тяжелым щелочным металлом. Его атомная масса составляет около 133 единиц, что делает его одним из самых тяжелых элементов в периодической системе. Тяжесть цезия обусловлена его большим ядерным размером и высоким числом нейтронов, что влияет на его химические и физические свойства.
Цезий широко применяется в различных областях науки и технологии. Он используется в фотоэлементах, лазерной технике, ядерных реакторах и в других инженерных и исследовательских целях. Благодаря своим уникальным свойствам, цезий находит применение в физике, химии, медицине и других областях науки.
В заключение, цезий представляет собой реактивный и тяжелый щелочной металл, обладающий уникальными свойствами. Его высокая реактивность и тяжесть делают его важным элементом для различных научных и промышленных областей. Понимание химических и физических свойств цезия помогает разрабатывать новые материалы и технологии, которые способствуют прогрессу научных исследований и развитию современного общества.
Франций: редкий и ядерный щелочной металл

Франций – это химический элемент из группы щелочных металлов, который отличается своей редкостью и ядерными свойствами. Его атомный номер 87 и символ Fr.
Франций является самым редким естественным элементом на Земле. Его присутствие в земной коре крайне ограничено и встречается только в следах. Поэтому он получил свое название в честь Франции, где был впервые обнаружен в 1939 году.
Одной из уникальных особенностей франция является ее ядерная активность. Радиоактивный изотоп франция, франций-223, обладает очень коротким периодом полураспада – всего около 22 минуты. Это делает его крайне нестабильным и опасным для обработки и хранения.
Франция также известна своими химическими свойствами. Она реагирует с водой, кислородом и многими другими веществами, очень сильно, образуя различные химические соединения. Из-за этого франция считается крайне реактивным элементом.
Хотя франция имеет некоторые применения в научных исследованиях, она не имеет практического значения в повседневной жизни. Из-за ее крайней редкости и опасности обращения с ней, франций остается одним из самых малоизученных и малоизвестных щелочных металлов.
Уникальные применения щелочных металлов
1. Натрий:
Натрий является одним из основных элементов в производстве стекла. Он используется для придания прочности и прозрачности стеклу. Натрий также является ключевым компонентом в производстве различных видов щелочных аккумуляторов.
2. Калий:
Калий широко применяется в сельском хозяйстве и садоводстве. Он является необходимым элементом для растений, а его соединения используются в удобрениях, чтобы увеличить урожайность и улучшить качество плодов и овощей. Калий также используется в производстве мыла и мягких моющих средств.
3. Литий:
Литий используется в производстве литий-ионных аккумуляторов, которые широко применяются в портативных электронных устройствах, таких как мобильные телефоны и ноутбуки. Он также используется в производстве лекарственных препаратов для лечения биполярного расстройства и депрессии.
4. Рубидий:
Рубидий используется в научных исследованиях и различных технических приложениях, включая производство инфракрасных лазеров и оптических приборов. Рубидиевые соединения также применяются в медицине для некоторых видов радиоизотопной диагностики.
5. Цезий:
Цезий используется в атомной энергетике для производства радиоактивных источников тепла, используемых в космической навигации и в некоторых промышленных процессах. Цезиевые часы, основанные на точности излучения цезия, используются в научных лабораториях и во время космических миссий.
В целом, щелочные металлы имеют широкий спектр применений в различных отраслях и областях, благодаря своим уникальным свойствам и химическим реакциям. Они играют важную роль в развитии технологий и улучшении качества жизни человека.
Вопрос-ответ

Какие металлы относятся к щелочным?
К щелочным металлам относятся: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие свойства имеют щелочные металлы?
Щелочные металлы обладают следующими свойствами: низкой плотностью, низкой температурой плавления, мягкостью, способностью образовывать ионы с положительным зарядом, активной реакцией с водой и воспламенением на воздухе. Они также хорошо проводят тепло и электричество.
