Шелочные металлы, также известные как группа 1A или первая группа периодической таблицы элементов, представляют собой семейство химических элементов с общими характеристиками и свойствами. В этой статье мы рассмотрим список шелочных металлов и основные особенности каждого элемента.
Семейство шелочных металлов состоит из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Эти элементы имеют одно электрон в своей внешней оболочке, что делает их крайне реактивными и химически активными.
Шелочные металлы хорошо известны своей способностью выделять водород при реакции с водой, образуя щелочные гидроксиды. Реакция с водой может вызывать выброс газа и возгорание сложных соединений. Кроме того, они также проявляют металлические свойства, такие как хорошая термическая и электрическая проводимость.
Шелочные металлы также широко используются в промышленности для производства щелочей, сплавов, синтеза лекарственных препаратов и применяются в батареях и других электронных устройствах.
В целом, шелочные металлы играют важную роль в нашей повседневной жизни и имеют большое значение для различных отраслей промышленности и научных исследований.
Шелочные металлы: список элементов и их свойства
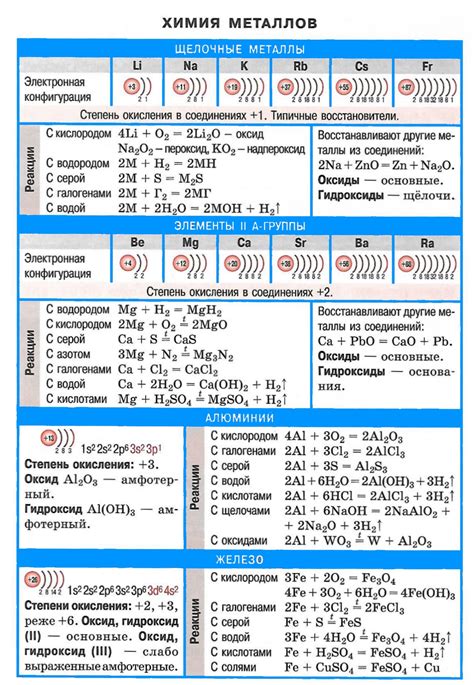
Шелочные металлы – это группа элементов, расположенных в первой группе периодической таблицы. Всего в эту группу входят шесть элементов: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
У шелочных металлов есть несколько общих характеристик. Во-первых, они являются химически активными и реагируют с водой и кислородом. Во-вторых, они обладают низкой плотностью и низкой температурой плавления. Кроме того, шелочные металлы имеют металлический блеск и проводят тепло и электричество.
Каждый из шелочных металлов имеет свои уникальные свойства. Например, литий является наименее плотным и наименее реактивным из всех шелочных металлов. Он также используется в литий-ионных аккумуляторах. Натрий очень распространен в природе и широко используется в пищевой промышленности. Калий является необходимым элементом для растений и используется в удобрениях.
Рубидий и цезий встречаются в природе в очень малых количествах. Они используются в научных исследованиях и в некоторых технологических процессах. Франций является самым редким и нестабильным из всех шелочных металлов и его свойства изучаются в основном в научных лабораториях.
Что такое шелочные металлы?

Шелочные металлы - это группа элементов периодической системы, которые характеризуются высокой реактивностью и способностью образовывать ионы с положительным зарядом. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Все шелочные металлы имеют протонное число равное 1, что делает их самыми легкими металлами в периодической системе. Они также характеризуются низкой плотностью, низкой температурой плавления и невысокой твердостью.
Шелочные металлы обладают способностью образовывать ионы с положительной однонаправленной зарядом, что делает их хорошими источниками электричества. Кроме того, они обладают высокой активностью в химических реакциях, особенно с водой и кислородом. Например, они реагируют с водой, образуя щелочные растворы и выделяя водород.
Из-за своей высокой реактивности и способности образовывать ионы с положительным зарядом, шелочные металлы широко используются в различных областях, включая производство щелочных батарей, легких сплавов, стекла и керамики. Также они играют важную роль в химической промышленности и электронике.
Какие элементы относятся к шелочным металлам?
Шелочные металлы - это химические элементы, которые относятся к первой группе периодической системы. Они представляют собой группу металлов с высокой активностью и химической реактивностью.
Всего в данную группу входят 6 элементов: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Шелочные металлы обладают рядом общих характеристик. Во-первых, они являются мягкими и легкими металлами с низкой плотностью. Они хорошо проводят тепло и электричество.
Во-вторых, шелочные металлы очень реактивны и легко реагируют с водой и кислородом. Они имеют низкую температуру плавления и кипения.
Шелочные металлы находят широкое применение в различных областях науки и технологий. Например, натрий используется в производстве стекла и мыла, а калий является важным элементом для растений и используется в удобрениях.
Кроме того, шелочные металлы имеют важное значение в медицине и фармацевтике. Литий, например, используется в лекарствах для лечения психических расстройств, таких как биполярное расстройство.
Таким образом, шелочные металлы - это группа элементов с уникальными свойствами, которые находят широкое применение в различных сферах человеческой деятельности.
Свойства шелочных металлов

Литий (Li) - легкий металл, имеющий высокую электроотрицательность и низкую плотность. Он обладает низкой температурой плавления и кипения, а также химической активностью. Литий является хорошим проводником электричества и тепла, поэтому широко применяется в батареях, сплавах и в промышленности.
Натрий (Na) - металл, имеющий серебристо-белый цвет. Он является достаточно мягким элементом и легко реагирует с кислородом и водой. Натрий используется в производстве щелочей, стекла и пластика. Он является необходимым элементом для поддержания нормального баланса электролитов в организме.
Калий (K) - металл, имеющий серебристо-белый цвет и низкую плотность. Он является очень реактивным элементом и легко растворяется в воде. Калий является важным элементом для живых организмов, участвуя в регуляции баланса жидкостей и электролитов. Он также используется в производстве удобрений и во многих химических реакциях.
Рубидий (Rb) - мягкий и серебристо-белый металл, который быстро окисляется на воздухе. Он обладает низкой плотностью и хорошей электрической проводимостью. Рубидий находит применение в электронике, в производстве фотоэлементов и в оптических приборах.
Цезий (Cs) - мягкий металл, имеющий наибольшую плотность среди всех элементов. Он очень активен химически и является отличным проводником тепла и электричества. Цезий применяется в некоторых типах атомных часов, в электронике и в некоторых медицинских процедурах.
Франций (Fr) - редкий и радиоактивный металл, который практически не встречается в природе. У него самая низкая электрическая и теплопроводность среди всех элементов. Франций используется в научных исследованиях и имеет ограниченное промышленное применение.
Применение шелочных металлов

Литий
Литий является одним из наиболее используемых шелочных металлов из-за своих уникальных свойств. Он широко применяется в производстве легких аккумуляторов, которые используются в мобильных телефонах, ноутбуках и электромобилях. Также литий используется в некоторых медицинских препаратах, таких как литийкарбонат, который используется в лечении биполярного аффективного расстройства.
Натрий
Натрий имеет широкое применение в пищевой, химической и фармацевтической промышленности. Соль натрия (хлорид натрия) является одной из самых распространенных пищевых добавок, которая используется для соления и консервирования различных продуктов. Натрий также необходим для нормального функционирования организма, и его соединения используются в производстве медикаментов.
Калий
Калий является неотъемлемым элементом для растений и используется в сельском хозяйстве как удобрение. Удобрение, содержащее калий, помогает повысить урожайность и качество сельскохозяйственных культур. Калий также применяется в производстве стекла, мыла и многих других промышленных продуктов.
Рубидий
Рубидий, несмотря на свою редкость, имеет ряд применений. Он используется в некоторых типах фоточувствительных элементов, таких как фотодиоды. Рубидиевые соединения также применяются в исследованиях в области оптики и физики высоких энергий.
Цезий
Цезий имеет применение в ядерной энергетике. Цезий-137 используется в источниках радиации для облучения раковых клеток, а также в качестве теплоносителя в некоторых типах ядерных реакторов. Он также может использоваться в атомных часах из-за стабильности его изотопов и способности точно измерять время.
Реакции шелочных металлов с водой и кислотами

Шелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают характерной реакцией с водой и кислотами. Эти металлы легко реагируют с водой, образуя щелочные растворы, и с кислотами, образуя соли.
Реакция шелочных металлов с водой происходит с выделением водорода. При взаимодействии с водой, металлы образуют гидроксиды и высвобождаются молекулы водорода. Например, при реакции натрия с водой получается натриевый гидроксид (щелочь) и водород:
2Na + 2H2O → 2NaOH + H2
Подобные реакции наблюдаются и с другими шелочными металлами. Каждый из них образует свой характерный гидроксид и выделяет молекулы водорода. Вода при этом превращается в основание.
Реакция шелочных металлов с кислотами также приводит к образованию солей и выделяет водород. Например, при взаимодействии натрия с соляной кислотой образуется соль натрия (хлорид натрия) и высвобождается водород:
2Na + 2HCl → 2NaCl + H2
Аналогичные реакции наблюдаются и с другими кислотами. Шелочные металлы образуют различные соли, в зависимости от кислоты, с которой они реагируют.
Реакции шелочных металлов с водой и кислотами являются типичными проявлениями их химических свойств. Эти реакции широко используются в химической промышленности и имеют большое практическое значение.
Опасность и меры предосторожности при работе с шелочными металлами
Шелочные металлы представляют опасность при неправильной обработке или непредусмотренной реакции с другими веществами. Они имеют высокую химическую активность и могут вызывать различные реакции и взрывы, если с ними не осторожно обращаться. Шелочные металлы входят в первую группу элементов периодической таблицы и включают литий, натрий, калий, рубидий, цезий и франций.
При работе с шелочными металлами необходимо соблюдать определенные меры предосторожности. Во-первых, необходимо носить защитные средства, включая защитные очки, респиратор, резиновые перчатки и защитную одежду. Это поможет избежать попадания шелочных металлов на кожу, в глаза или дыхательные пути. Также важно работать в хорошо проветриваемом помещении или использовать специальные вытяжные системы для удаления паров и газов.
Для обработки шелочных металлов необходимо использовать специальные инструменты из нереактивных материалов, таких как пинцеты или лопатки из пластика или керамики. Металлические инструменты могут вызвать реакцию с шелочными металлами и привести к опасным последствиям. Также не рекомендуется хранить шелочные металлы в близком контакте с водой, кислотами или другими веществами, которые могут вызвать реакцию.
В случае аварийной ситуации, такой как разлив или возгорание шелочных металлов, необходимо немедленно принять меры предосторожности. Изолируйте зону, предупредите других людей и вызовите экстренные службы. Не пытайтесь бороться с возгоранием самостоятельно, так как шелочные металлы могут реагировать с водой или кислородом, что может привести к усилению огня или взрыву. Работа с шелочными металлами требует особого внимания и знания основных мер предосторожности, чтобы избежать непредсказуемых ситуаций и обеспечить безопасность работников.
Вопрос-ответ

Какие элементы входят в список шелочных металлов?
К шелочным металлам относятся следующие элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Каковы основные свойства шелочных металлов?
Шелочные металлы обладают следующими свойствами: низкой плотностью, низкой температурой плавления и кипения, мягкостью (легко режутся ножом), химической реактивностью (легко реагируют с кислородом и водой), способностью образовывать оксиды и гидроксиды.
Как шелочные металлы используются в промышленности?
Шелочные металлы имеют широкое применение в различных отраслях промышленности. Например, литий используется в производстве легких сплавов для авиации, натрий применяется в процессе производства стекла и мыла, калий используется в удобрениях для растений. Кроме того, шелочные металлы используются в производстве батарей и аккумуляторов, а также являются важными компонентами в фармацевтической и косметической промышленности.
